-
随着世界人口的急剧增长,工业的蓬勃发展,淡水供应危机日益成为世界关注的焦点。海水约占地球现有总水量的96.5%,海水淡化问题已成为科学家研究的主要方向。若实行海水淡化供应饮用水,下列方法在原理上完全不可行的是( )
A. 加明矾,使海水中的盐分沉淀并淡化
B. 利用太阳能,将海水蒸馏淡化
C. 将海水通过离子交换树脂,以除去所含的盐分
D. 利用半透膜,采用反渗透法而使海水淡化
难度: 中等查看答案及解析
-
我国古代有“女娲补天”的传说,今天人类也面临“补天”的问题,下列采取的措施与今天所说的“补天”无关的是( )
A.研究新型催化剂,消除汽车尾气的污染
B.禁止使用含氟电冰箱
C.倡导使用无磷洗衣粉
D.严格控制硝酸厂的尾气处理
难度: 中等查看答案及解析
-
人们把食品分为绿色食品、蓝色食品、白色食品等。绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的食品叫蓝色食品,通过微生物发酵制得的食品叫白色食品。下面属于白色食品的是( )
A. 酱油 B. 面粉 C. 海带 D. 菜油
难度: 简单查看答案及解析
-
近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是( )
A. 提高汽油燃烧效率 B. 降低汽油成本
C. 避免铅污染大气 D. 铅资源短缺
难度: 中等查看答案及解析
-
可逆反应A(g)+ 4B(g)
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.01 mol/(L·s)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 物质发生化学变化都伴随着能量变化
B. 任何反应中的能量变化都表现为热量变化
C. 伴有能量变化的物质变化都是化学变化
D. 没有物质的变化,就没有能量的变化
难度: 简单查看答案及解析
-
关于热化学方程式下列说法正确的是( )
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C. 书写热化学方程式时,不仅要写明反应热的符号和数值还要注明各物质的聚集状态
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
难度: 中等查看答案及解析
-
如图所示的装置能够组成原电池产生电流的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
① C(s) + O2(g) = CO2(g) ;ΔH1 C(s) +
O2(g) = CO(g) ;ΔH2
② S(s) + O2(g) =SO2(g) ;ΔH3 S(g) + O2(g) = SO2(g) ;ΔH4
③ H2(g) +
O2(g) =H2O(l) ;ΔH5 2H2(g) + O2(g) = 2H2O(l) ;ΔH6
④ CaCO3(s) = CaO(s) + CO2(g) ;ΔH7 CaO(s) + H2O(l) = Ca(OH)2(s) ;ΔH8
A. ① B. ④ C. ②③④ D. ①②③
难度: 中等查看答案及解析
-
生产中常要控制化学反应条件增大反应速率。下列措施中不能加快化学反应速率的是
A. 尽可能使用稀溶液 B. 选择合适的催化剂
C. 碾细固体反应物 D. 提高反应体系的温度
难度: 中等查看答案及解析
-
下列变化为放热的化学反应的是( )
A. H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B. 2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C. 形成化学键时共放出862 kJ能量的化学反应
D. 能量变化如图所示的化学反应

难度: 中等查看答案及解析
-
一些烷烃的燃烧热(kJ/mol)如下表:
化合物
燃烧热
化合物
燃烧热
甲烷
891.0
正丁烷
2 878.0
乙烷
1 560.8
异丁烷
2 869.6
丙烷
2 221.5
2甲基丁烷
3 531.3
下列表达正确的是( )
A. 热稳定性:正丁烷>异丁烷
B. 乙烷燃烧的热化学方程式为
2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ/mol
C. 正戊烷的燃烧热大于3 531.3 kJ/mol
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
难度: 中等查看答案及解析
-
实验室进行中和热测定的实验时除需要大烧杯(500 mL)、小烧杯(100 mL)外,所用的其他仪器和试剂均正确的一组是( )
A. 0.50 mol·L-1盐酸,0.50 mol·L-1NaOH溶液,100 mL量筒1个
B. 0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,100 mL量筒2个
C. 0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒1个
D. 0.50 mol·L-1盐酸,0.55 mol·L-1NaOH溶液,50 mL量筒2个
难度: 中等查看答案及解析
-
我国拥有较丰富的地热资源,其开发利用前景广阔。下列关于地热能说法正确的是 ( )
①可以用于洗浴、发电以及供暖等方面
②与煤炭、石油、天然气一样都是化石能源
③主要源于地球内部放射性元素衰变产生的能量
④与地下水结合可形成热水型地热,释放形式之一是温泉
A. ①②③ B. ①②④
C. ①③④ D. ②③④
难度: 中等查看答案及解析
-
下列反应中前者属于取代反应,后者属于加成反应的是( )
A. 乙烯使溴的四氯化碳溶液褪色;甲烷与氯气混和后光照反应
B. 乙烯通入酸性KMnO4溶液中,溶液褪色;苯与氢气在一定条件下反应生成环己烷
C. 苯滴入浓硝酸和浓硫酸的混合液中,有油状液体生成 ; 乙烯与水生成乙醇的反应
D. 在苯中滴入溴水,溴水褪色 ; 乙烯自身生成聚乙烯的反应
难度: 简单查看答案及解析
-
下列关于实验现象的描述,不正确的是( )
A. 将苯和汽油的混合物放在分液漏斗中振荡、静置后可分为两层
B. 在盛有乙醇的试管中加入几滴酸性KMnO4溶液,可观察到紫色褪去
C. 将石蕊试液滴入醋酸溶液中,可以看到石蕊试液变红
D. 用灯光照射盛有CH4与Cl2(体积之比1∶4)的集气瓶后,可观察到瓶内壁附有油状物
难度: 中等查看答案及解析
-
纪录片《舌尖上的中国》展示了中华饮食文化的博大精深。下列烹饪用品的调味成分属于酯类的是( )
A. 食盐 B. 大豆油 C. 陈醋 D. 蔗糖
难度: 简单查看答案及解析
-
实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊溶液1 mL,发现紫色石蕊溶液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管)。下列有关该实验的描述,不正确的是( )
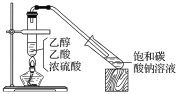
A. 制备的乙酸乙酯中混有乙酸和乙醇杂质
B. 该实验中浓硫酸的作用是催化和吸水
C. 饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
D. 石蕊层为三层,由上而下是蓝、紫、红
难度: 中等查看答案及解析
-
一定条件下:甲分子和乙分子反应生成丙分子和丁分子,下列说法不正确的是( )

A. 分离甲和丙可以采用蒸馏法 B. 甲的空间构型是平面正六边形
C. 丙不属于烃类物质 D. 该反应类型是置换反应
难度: 中等查看答案及解析
 .
.