-
下列有关生产、生活中的叙述正确的是
A. 煤经过气化和液化两个化学变化,可变为清洁能源
B. 古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品
C. 明矾可用于水的杀菌消毒,碳酸钡可用于钡餐透视
D. 单晶硅太阳能电池板可以将太阳能直接转变为机械能
难度: 简单查看答案及解析
-
以NA 表示阿伏加德罗常数的值,下列说法正确的是
A. T ℃时,1 L pH=6的纯水中,含10-8NA个
B. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.4NA
C. 1 mol SiO2中含有30 mol 电子
D. 14 g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA
难度: 简单查看答案及解析
-
分子中碳与氢两元素的质量比为21∶4的烃中主链上有5个碳原子的结构共有
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
在下列给定条件下的溶液中,一定能大量共存的离子组是
A. 无色溶液:Ca2+、H+、Cl-、HSO3-
B. 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C. FeCl2溶液:K+、Na+、SO42-、AlO2-
D. 加水稀释时c(H+)/c(OH-)值明显增大的溶液中:Ba2+、Cl-、NO3-、Na+
难度: 中等查看答案及解析
-
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号
c(HA)/mo1·L-1
c(NaOH)/mo1·L-1
反应后溶液pH
甲
0.1
0.1
pH=9
乙
c1
0.2
pH=7
下列判断不正确的是
A. 0.1 mo1·L-1的HA溶液中由水电离出的c(H+)=1×l0-13mo1/L
B. c1一定大于0.2 mo1·L-1
C. 甲反应后的溶液中:HA占含A微粒总数的0.02%
D. 乙反应后的溶液中:c(Na+)<c(HA)+c(A一)
难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是
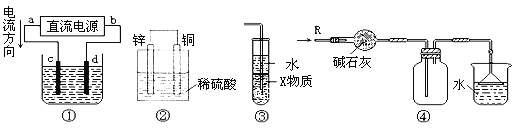
A. 若采用装置①铝件镀银,则c极为铝件,d极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③中X若为四氯化碳,用于吸收氨气或氯化氢,会引起倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
难度: 中等查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
NH3
CaCl2
④
CO2
SO2
Ba(NO3)2
⑤
NO2
SO2
BaCl2
A. ②③④ B. ①②④⑤ C. ②③④⑤ D. ①②③④⑤
难度: 中等查看答案及解析

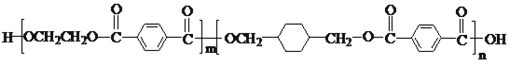
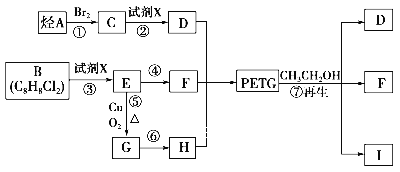
 请写出由D及其它必要物质可合成
请写出由D及其它必要物质可合成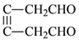 的反应历程________________________________。
的反应历程________________________________。