-
有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应
B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的炭与CO2反应
D.甲烷在O2中的燃烧反应难度: 中等查看答案及解析
-
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电.电池负极反应为( )
A.H2+2OH-=2H2O+2e-
B.O2+4H++4e-=2H2O
C.H2=2H++2e-
D.O2+2H2O+4e-=4OH-难度: 中等查看答案及解析
-
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+)=c(SO42-)
B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-)
D.c(OH-)+c(SO42-)=c(H+)+c(NH4+)难度: 中等查看答案及解析
-
可逆反应2HI(g)⇌I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是( )
A.各组分的物质的量
B.混合物的颜色
C.容器内压强
D.混合气体的颜色难度: 中等查看答案及解析
-
已知:(1)Zn(s)+
O2(g)=ZnO(s)△H=-348.3kJ•mol-1
(2)4Ag(s)+O2(g)=2Ag2O(s)△H=-62.0kJ•mol-1
则Zn(s)+Ag2 O(s)=Zn O(s)+2Ag(s)△H 等于( )
A.-379.3kJ•mol-1
B.-317.3kJ•mol-1
C.-332.8kJ•mol-1
D.317.8kJ•mol-1难度: 中等查看答案及解析
-
有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是( )
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.HX、HY、HZ三者均为弱酸
C.在X-、Y-、Z-三者中以Z-最易发生水解
D.中和1molHY酸,需要的NaOH稍小于1mol难度: 中等查看答案及解析
-
经一定时间后,可逆反应aA+bB⇌cC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( )
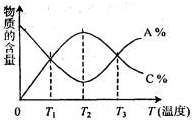
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动难度: 中等查看答案及解析
-
参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )

A.正反应为吸热反应
B.正反应为放热反应
C.加入催化剂,该化学反应的反应热增大
D.从图中可看出,该反应的反应热与途径有关难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4υ正(O2)=5υ逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)难度: 中等查看答案及解析
-
可逆反应mA(g)⇌nB(g)+pC(s);△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合如图中的两个图象,以下叙述正确的是:( )

A.m>n,Q<0
B.m>n+p,Q>0
C.m>n,Q>0
D.m<n+p,Q<0难度: 中等查看答案及解析
-
可以判定某酸(HA)是强电解质的事实是( )
A.该酸加热至沸腾不分解
B.0.01mol•L-1该酸的pH=2
C.该酸可以溶解Cu(OH)2
D.该酸与CaCO3反应放出CO2难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大难度: 中等查看答案及解析
-
下列说法或表示法正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式是2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
C.温度、浓度的改变一定会引起速率的改变,所以化学平衡一定会移动
D.酸与碱恰好完全反应生成正盐的c(H+)=c(OH-)=10-6mol/L的溶液一定呈中性难度: 中等查看答案及解析
-
已知各物质的溶度积:
FeS:Ksp=6.3×10-18mol2•L-2
CuS:Ksp=1.3×10-36mol2•L-2
下列说法正确的是( )
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂难度: 中等查看答案及解析
-
图Ⅰ是NO2(g)+CO(g)⇌CO2(g)+NO(g)反应过程中能量变化示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态.当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ.下列有关说法正确的是( )
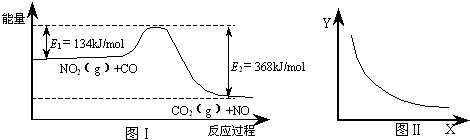
A.该反应的焓变△H=-234kJ/mol
B.若X表示体系的压强,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.增大CO的起始浓度,平衡向正反应方向移动,反应热增大难度: 中等查看答案及解析
-
如图所示是根据图甲的电解池进行电解时,某个量(纵坐标x)随时间变化的函数图象(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x表示( )

A.各电解池析出气体的体积
B.各电解池阳极质量的增加量
C.各电解池阴极质量的增加量
D.各电极上放电的离子总数难度: 中等查看答案及解析


