-
一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L,则下列叙述中错误的是
A.气体甲为SO2和H2的混合物
B.气体甲中SO2与H2的体积之比为4:1
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
难度: 困难查看答案及解析
-
下列说法不正确的是
A.利用风能发电、采取节能技术、使用太阳能热水器均有利于减少二氧化碳排放
B.生活垃圾焚烧发电也会产生有毒有害物质
C.丁达尔现象可用于区别溶液与胶体,云、雾、淀粉溶液均能产生丁达尔现象
D.硅酸钠溶液的保存和碱溶液一样,存放在橡胶塞密封的广口试剂瓶中
难度: 简单查看答案及解析
-
下列说法正确的是
A.相对分子质量越大的分子组成的物质,其熔沸点越高
B.在相同物质的量的情况下,多元酸溶液的酸性都比一元酸溶液强
C.在复分解反应中弱酸也可以生成强酸
D.同一元素,价态越高,氧化性肯定越强
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
A.硫离子的结构示意图:
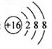
B.原子核内有10个中子的氧离子:
C.NH4Cl的电子式:
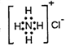
D.乙烯的结构简式C2H4
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数。下列说法中,正确的是
A.1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA
B.标准状况下,22.4LSO3含有NA个分子
C.标准状况下,
11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA
D.60 g石英晶体中含有的Si-O键数目为2NA
难度: 困难查看答案及解析
-
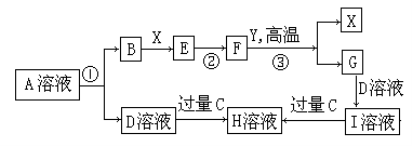
下图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和。下列说法正确的是
X
Y
Z
W
A.X元素形成的气态氢化物分子的空间结构是三角形
B.Z与W元素形成的化合物是分子晶体
C.W单质受热蒸发时吸收的热量用于克服共价键
D.化合物XW3中W的化合价为-1价
难度: 中等查看答案及解析
-
采用循环操作可以提高原料的利用率,下列工业生产中,没有采用循环操作的是
A、氯碱工业 B、硫酸工业 C、硝酸工业 D、合成氨工业
难度: 简单查看答案及解析
-
下列各组物质的性质比较,正确的是
A.熔点:CO2<H2O<SiO2<KCl B.稳定性:H2O<NH3<PH3<SiH4
C.酸性:H3PO4>H2SO4>HClO4>H2SiO3 D.粒子半径:K+>Na+>Mg2+>Al3+
难度: 中等查看答案及解析
-
下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是
① 向
Ca(ClO)2溶液中通入过量CO2
② 向AlCl3溶液中逐滴加入过量氨水
③ 向AgNO3溶液中逐滴加入过量氨水
④ 向Na2SiO3溶液中逐滴加入过量的盐酸
A.只有②③ B.只有①③ C.只有①②③ D.①②③④
难度: 中等查看答案及解析
-
下列过程中,破坏的作用力相同的是
A.干冰升华和碘升华 B.HCl溶于水和NaCl溶于水
C.石英熔化和冰熔化 D.NH4Cl受热分解和HI受热分解
难度: 中等查看答案及解析
-
下列有关物质的分类或归类正确的是
①混合物:波尔多液、盐酸、水银
②化合物:氯化钾、甲烷、HD
③电解质:明矾、胆矾、硫酸钡
④非电解质:酒精、CO2、Cl2
⑤同位素:12C、13C、14C
A.③④ B.③⑤ C.②③⑤ D.②④
难度: 中等查看答案及解析
-
三种不同物质有如图所示转化关系:甲
乙
丙
甲,则甲不可能是
A.CO2 B.NH4Cl C.Al2O3 D.SiO2
难度: 中等查看答案及解析
-
酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是
A.R和N元素的原子含有相同数目的未成对电子
B.RO3-中R的化合价与NO3-中的N的化合价不相等
C.RO3-和NO3-只能被还原,不能被氧化
D.R原子的电子层数比N的电子层数多1
难度: 中等查看答案及解析
-
某结晶水合物的化学式为R•nH2O,其相对分子量为M。25℃时,将ag该晶体溶于bg水中恰好形成VmL饱和溶液,下列关系式正确的是
A.饱和溶液的物质的量浓度为c=
mol·L-1
B.饱和溶液中溶质的质量分数为w=
%
C.25℃时R的溶解度为S=
g
D.饱和溶液的密度为ρ=
g·L-1
难度: 困难查看答案及解析
-
下列现象或事实可用同一原理加以解释和说明的是
A.氯化铵和碘都可以用加热法进行提纯
B.浓硫酸和浓盐酸长期暴露在空气中浓度降低
C.硫酸亚铁溶液和氢氧化钠溶液在空气中久置后均会变质
D.二氧化硫气体均能使高锰酸钾溶液和溴水褪色
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在含有Al3+、Cl-的溶液中:HCO3-、I-、NH4+、Mg2+
C.在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl-
D.常温下,在c(H+)=1×10-13mol·L-1的溶液中:Na+、S2-、SO32-、NO3-
难度: 困难查看答案及解析
-
下列离子反应方程式正确的是
A.在碳酸氢镁溶液中加入足量Ca(OH)2溶液:
Mg2++HCO3-+Ca2++2OH–== MgCO3↓+CaCO3↓+2H2O
B.向饱和碳酸钠溶液通入过量的二氧化碳气体:CO32-+CO2+H2O=2HCO3-
C.将氯化亚铁溶液和稀硝酸混合:3Fe2++ 4H++NO3-= 3Fe3++2H2O+NO↑
D.向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全:
Al3+ +SO42—+Ba2+ +3OH—==BaSO4↓+Al(OH)3↓
难度: 困难查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH— Fe3O4+S4O62-+2H2O下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为3mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=6
难度: 困难查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是
A.在含等物质的量的AlO2-、OH-、CO32--的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3
D.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
难度: 困难查看答案及解析
-
把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
难度: 困难查看答案及解析
-
铋(Bi)位于元素周期表中ⅤA族,+3价较稳定,铋酸钠(NaBiO3)溶液呈无色。取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
加入溶液
①适量的铋酸钠溶液
②过量的双氧水
③适量KI淀粉溶液
实验现象
溶液呈紫红色
紫红色消失,产生气泡
溶液变成蓝色
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱(从左至右)的顺序为
A.NaBiO3、KMnO4、H2O2、I2
B.I2、H2O2、KMnO4、NaBiO3
C.KMnO4、NaBiO3、I2、H2O2
D.H2O2、I2、NaBiO3、KMnO4
难度: 困难查看答案及解析
-
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙的化学式为YZ3,丙是由X、Y、Z组成的盐。下列说法正确的是
A.原子半径:W>Y>Z,而离子半径: Z>Y>W
B.化合物丙中只存在共价键
C.测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度
D.甲沸点远高于乙,可能是甲分子间存在氢键所致
难度: 中等查看答案及解析
-
将NaOH溶液逐滴加入NH4HCO3溶液中(忽略溶液体积的变化),下列各示意图表示的混合溶液有关量的变化趋势正确的是
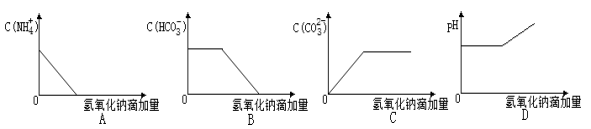
难度: 中等查看答案及解析
-
a mol FeS与b mol FeO投入到v L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④[cV-(9a+b)/3 ]mol
A.①④ B.②③ C.①③ D.②④
难度: 困难查看答案及解析
-
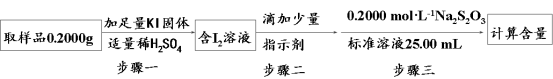
已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中不正确的是
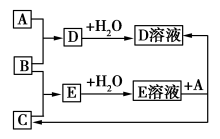
A.A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B.A、B、C中三种元素形成的化合物所属物质类别一定不是碱
C.如果E溶液是一种强酸,则E溶液为盐酸
D.A、B、C中有一种金属且为A
难度: 极难查看答案及解析
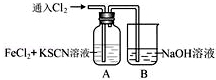
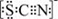 .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.