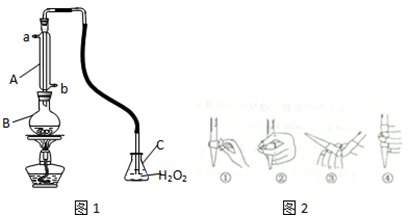
-
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
难度: 中等查看答案及解析
-
下列实验可实现鉴别目的的是
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
难度: 中等查看答案及解析
-
下列叙述正确的是
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
难度: 中等查看答案及解析
-
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
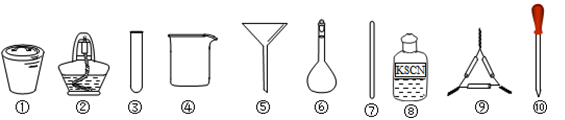
A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验中滤液中的Fe3+,选用③、⑧和⑩
难度: 中等查看答案及解析
-
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图所示(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是
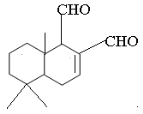
A.Br2的CCl4溶液
B.Ag(NH3)2OH溶液
C.HBr
D.H2
难度: 中等查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
2C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
A.-332 B.-118 C.+350 D.+130
难度: 中等查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
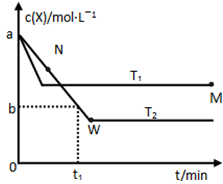
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
难度: 中等查看答案及解析
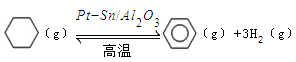 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。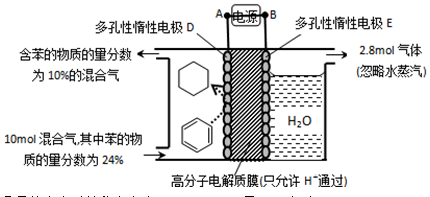
 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)