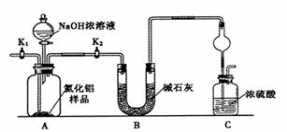
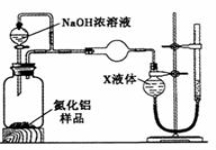
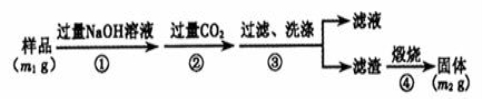
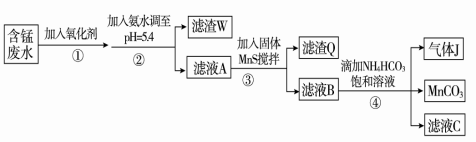
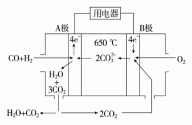
-
下列关于“化学与健康”的说法不正确的是
A.服用铬含量超标的药用胶囊会对人体健康造成危害
B.食用一定量的油脂能促进人体对某些维生素的吸收
C.“血液透析”利用了胶体的性质
D.光化学烟雾不会引起呼吸道疾病
难度: 简单查看答案及解析
-
下列关于物质分类的说法正确的是
A.金刚石、白磷都属于单质 B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质 D.葡萄糖、蛋白质都属于高分子化合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下, NA个SO3的体积为22.4 L
B.1 mol Fe与足量的HCl溶液反应,转移的电子数为3NA
C.2 L 1
mol·L-1的H3
PO4溶液中所含的H+数为6NA
D.标准状况下22.4 L Cl2通入足量的石灰乳制备漂白粉,转移电子数为NA
难度: 困难查看答案及解析
-
某溶液中含有NH4+、Mg2+、Fe2+、Al3+和SO42-五种离子,若向其中加入过量的Ba(OH)2 溶液,加热并搅拌,再加入过量的氢碘酸,原溶液中大量减少的离子有
A.4种 B.3种 C.2种 D.1种
难度: 中等查看答案及解析
-
能正确
表示下列反应的离子方程式是
A.CuCl2溶液中加入少量氨水:Cu2++2OH-=Cu(OH)2↓
B.向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO
2↓+3SO42-+2H2O
C.向碳酸氢钙溶液中加足量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
D.铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多2,W与X同主族,则
A. 原子半径:Y<Z<W
B. 单质的还原性:Y<Z
C. 简单气态氢化物的稳定性:X>W
D. Y和Z两者最高价氧化物对应的水化物不能相互反应
难度: 中等查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液,再进行如下操作,结论正确的是
选项
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有SO42-
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫红色
原溶液中有I-
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
D
滴加稀NaOH溶液,将红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
难度: 中等查看答案及解析
-
在两个容积相同的密闭容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,在同温同压下,两容器内的气体一定具有相同的
A.原子数 B.分子数 C.质量 D.密度
难度: 中等查看答案及解析
-
已知NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
难度: 中等查看答案及解析
-
已知:Ksp(AgCl
) = 1.8 × 10-10 ,Ksp(AgI) = 1.5 × 10-16 ,Ksp(Ag2CrO4) =2.0 × 10-12,则在相同温度下,下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>Ag2CrO4 B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
难度: 中等查看答案及解析
-
有四种混合溶液,分别由等体积0.1mol·L-1的2种溶液混合而成①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3。下列关于该四种混合溶液的各项排序正确的是
A.pH:②>③>④>①
B.c(CH3COO-):②>④>③>①
C.c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
难度: 困难查看答案及解析
-
某温度下,H2(g)+CO2(g)
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确是
起始浓度
甲
乙
丙
c(H2)/mol·L-1
0.010
0.020
0.020
c(CO2)/mol·L-1
0.010
0.010
0.020[
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
难度: 困难查看答案及解析
-
环保、安全的铝--空气电池的工作原理如图所示,下列有关叙述错误的是
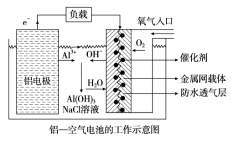
A.NaCl的作用是增强溶液的导电性
B.正极的电极反应式为O2+4e-+2H2O==4OH-
C.电池工作过程中,电解质溶液的pH不断增大
D.用该电池做电源电解KI溶液制取1molKIO3,消耗铝电极的质量为54g
难度: 困难查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是
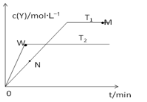
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.N点的逆反应速率v逆大于W点的逆反应速率v逆
C.T1 > T2
D.M点时再加入一定量X,平衡后X的转化率减小
难度: 困难查看答案及解析
-
室温下,用0.1 mol/L HCl溶液滴定10 mL 0.1 mol/L Na2CO3溶液,滴定曲线如图所示。下列说法正确的是

A.a点时:c(Na+)>c(CO32-)>c (HCO3-)>c(OH-)
B.b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.水电离程度由大到小的顺序为:a>b>c>d
D.d点时:c(H+)>c(HCO3-)=c(CO32-)
难度: 困难查看答案及解析
-
向1L含0.01molNaAlO2和0.02molNaOH
的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01mol < n(CO2) < 0.015 mol时发生的反应是:2 NaAlO2 + CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)>c(OH-)>c(CO32-)
C
0.015
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)
D
0.03
c(Na+)> c(HCO3-
)>c(OH-)>c(H+)
难度: 困难查看答案及解析