-
化学在生产和生活中有重要的应用,下列说法正确的是
A. 新型材料聚酯纤维、光导纤维都属于有机高分子化合物
B. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
C. 福尔马林可作食品的保鲜剂
D. “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量
难度: 简单查看答案及解析
-
下列有关物质性质或用途的说法正确的是
A. 铜的金属活动性比铁的弱,铜不能与任何强酸发生反应
B. 浓硫酸可用作干燥剂是因为其具有强氧化性
C. 利用Al2O3制作的坩埚,可用于熔融烧碱
D. 制水泥和玻璃都用石灰石作原料
难度: 简单查看答案及解析
-
下列表示物质结构的化学用语或模型图正确的是
A. HClO的结构式:H-Cl-O B. NH3分子的电子式:
C. CO2的比例模型:
D. 18O的原子结构示意图:
难度: 简单查看答案及解析
-
将铜和氧化铁的混和物溶于足量稀盐酸中,向所得溶液中滴入2滴KSCN溶液后出现红色。下列有关说法错误的是
A. 容器中可能有固体残渣 B. 所得溶液中一定存在Fe2+
C. 反应过程中水的电离程度增大 D. 再加入铜后,溶液红色逐渐退去
难度: 简单查看答案及解析
-
下图是某同学用 500 mL 容量瓶配制 0.10 mol·L-1NaOH 溶液的过程:

该同学的错误步骤有
A. 1 处 B. 2 处 C. 3 处 D. 4 处
难度: 中等查看答案及解析
-
下列溶液中离子或分子有可能大量共存的是
A. 由水电离出的c(H )=10-13mol/L 溶液:Mg2+、Cu2+、SO42-、NO3-
B. 无色溶液中:Na+、NH4+、Cl-、S2-
C. 高锰酸钾溶液:Fe3+、H+、SO42-、C2H5OH
D. 中性溶液中:Fe3+、K+ 、Cl-、SO42-
难度: 中等查看答案及解析
-
已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列结论正确的是
A. 碳的燃烧热大于110.5 kJ·mol-1
B. 反应①的反应热为221 kJ·mol-1
C. 98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
D. 稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量
难度: 中等查看答案及解析
-
一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物用C6H10O5表示。下列有关说法正确的是
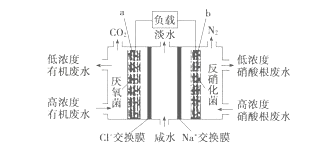
A. b电极为该电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
D. 中间室:Na+移向左室,Cl-移向右室
难度: 困难查看答案及解析
-
如图,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是
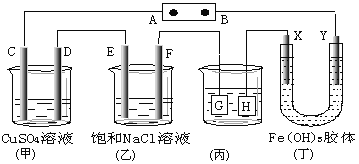
A. 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-=4OH-
B. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
C. (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
D. C、D、E、F电极均有单质生成,其物质的量比为1∶1∶2∶2
难度: 困难查看答案及解析
-
下列说法正确的是
A. 焓变和熵变都大于0的反应肯定是自发的
B. 焓变小于0而熵变大于0的反应肯定是自发的
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. 在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向
难度: 简单查看答案及解析
-
已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量NO2气体,且起始时体积相同。发生反应:2NO2(g)
N2O4(g) △H<0。一段时间后均达到平衡状态。下列说法中正确的是
A. 平衡时NO2体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
难度: 困难查看答案及解析
-
下列与有机物的结构、性质的有关叙述中正确的是
A. 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
B. 乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应
C. 分馏、干馏都是物理变化,裂化、裂解都是化学变化
D. 石油经过分馏得到多种烃,煤经过分馏可制得焦炭、煤焦油等产品
难度: 中等查看答案及解析
-
以下判断,结论正确的是( )
选项
项目
结论
A
三种有机化合物:丙烯、氯乙烯、苯
分子内所有原子均在同一平面
B
由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
属于同一反应类型
C
乙烯和苯都能使溴水褪色
褪色的原理相同
D
C4H9Cl的同分异构体数目(不考虑立体异构)
共有4种
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
氯原子对O3的分解有催化作用:O3(g)+Cl(g)===ClO(g)+O2(g) ΔH1 ①
ClO(g)+O(g)===Cl(g)+O2(g) ΔH2 ②
该反应的能量变化如图所示,下列叙述中正确的是

A. 反应O3(g)+O(g)===2O2(g)的ΔH=E1-E2
B. 反应O3(g)+O(g)===2O2(g)的ΔH=E2-E3
C. 反应O3(g)+O(g)===2O2(g)是吸热反应
D. 反应O3(g)+O(g)===2O2(g)的ΔH=ΔH1+ΔH2
难度: 困难查看答案及解析
-
如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )

A. 电流表指针不发生偏转
B. Al、Pt两极有H2产生
C. 甲池pH减小,乙池pH不变
D. Mg、C两极生成的气体在一定条件下可以恰好完全反应
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是

A. 由图甲可以判断:对于反应A(g)+B(g)
2C(g),若T1>T2,则ΔH<0
B. 图乙表示可逆反应CO(g)+H2O(g)
CO2(g)+H2(g) ΔH>0
C. 图丙表示CO2通入饱和Na2CO3溶液中,溶液导电性变化
D. 图丁表示0.1 mol·L-1的盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液pH随加入盐酸体积的变化
难度: 困难查看答案及解析
-
下列有关溶液组成的描述合理的是
A. 无色溶液中可能大量存在Al3+、NH
、Cl-、S2-
B. 酸性溶液中可能大量存在Na+、ClO-、SO
、I-
C. 中性溶液中可能大量存在Fe3+、K+、Cl-、SO
D. 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO
难度: 中等查看答案及解析
-
下图所示与对应叙述相符的是



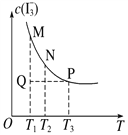
图1 图2 图3 图4
A. 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B. 图2表示反应中某反应物的正、逆反应速率随温度变化情况,由图可知该反应的正反应是吸热反应
C. 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y
Z
D. 图4表示溶液中反应:I2 + I-
I3- 平衡c(I3-)随温度变化,反应速度V(正)M<V(逆)N
难度: 困难查看答案及解析
-
在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2 (g) +3H2 (g)
CH30H(g)十H2 O (g)△H= -25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是
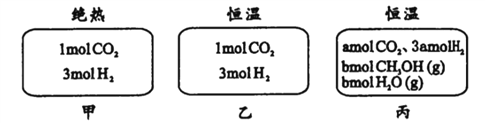
A. 刚开始反应时速率:甲>乙
B. 平衡后反应放热;甲>乙
C. 500℃下该反应平衡常数:K =3×102
D. 若a≠0,则0.9<b<l
难度: 中等查看答案及解析
-
最近报道了一种新型可逆电池,该电池的负极为金属铝,正极为石墨化合物Cn[AlCl4],电解质为R+(烃基取代咪唑阳离子)和[AlCl4]-阴离子组成的离子液体。电池放电时,在负极附近形成双核配合物[Al2Cl7]-。充放电过程中离子液体中的阳离子始终不变。下列说法中错误的是
A. 放电时,正极反应式为Cn[AlCl4]+e-=[AlCl4]-+ Cn
B. 充电时,阴极反应式为4[Al2Cl7]—3e-= Al+7[AlCl4]-
C. 放电过程中,负极每消耗1mol Al,导线中转移的电子数为3NA(NA为阿伏伽德罗常数的值)
D. 充、放电过程中,R+的移动方向相反
难度: 困难查看答案及解析
-
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
难度: 困难查看答案及解析
-
加热N2O5依次发生的分解反应为:
①N2O5(g)
N2O3(g)+O2(g)
②N2O3(g)
N2O(g)+O2(g)
在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为
A. 8.5 B. 9.6 C. 10.2 D. 10.7
难度: 困难查看答案及解析
-
已知反应
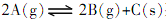 ,某温度下的平衡常数为4,此温度下,在2L的密闭容器中加入amolA,反应到某时刻测得各组分的浓度如下表,则下列说法中正确的是
,某温度下的平衡常数为4,此温度下,在2L的密闭容器中加入amolA,反应到某时刻测得各组分的浓度如下表,则下列说法中正确的是
A. a=1.0
B. 此时刻正反应速率小于逆反应速率
C. 在相同条件下,若起始时加入2amolA,则达到平衡时A的转化率减小
D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
难度: 中等查看答案及解析