-
下列各组物质的分组不正确的是
A.强电解质AlCl3、BaSO4、H2SO4
B.非电解质SO2、C2H5OH、NH3
C.碱性氧化物MgO、Na2O2、Al2O3
D离子化合物NH4Cl、Al2O3、MgO
难度: 简单查看答案及解析
-
下列微粒中不能破坏水的电离平衡的是:
A. Na HSO4 B. Al3+ C. CO32- D. K+
难度: 简单查看答案及解析
-
实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是:
A. 防止硫酸铁分解 B. 抑制硫酸铁水解
C. 提高硫酸铁的溶解度 D. 提高溶液的PH
难度: 简单查看答案及解析
-
把1mL0.1mol/L的H2SO4溶液加入蒸馏水中,制成200ml溶液,稀释后的H2SO4中,由水自身电离产生的c(H+)最接近:
A、1×10-13mol/L B、1×10-3mol/L
C、1×10-7mol/L D、1×10-11mol/L
难度: 简单查看答案及解析
-
在平衡体系中:H2S
H++HS-,HS-
H++S2-,增大溶液的pH值时,则c(S2-)变化正确的是( )
A.增大 B.可能增大也可能减小 C.减小 D.不变
难度: 简单查看答案及解析
-
把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:
Ca(OH)2(s)
Ca2++2OH-下列说法正确的是
A.恒温下向溶液中加CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
难度: 简单查看答案及解析
-
实验室现有三种酸碱指示剂,其pH变色范围如下 : 甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0,用0.1000 mol·L-1 NaOH 溶液滴定未知浓度的 CH3COOH 溶液,反应恰好完全时,下列叙述中正确的是
A.溶液呈中性,可选用甲基橙或酚酞做指示剂
B.溶液呈中性,只能选用石蕊做指示剂
C.溶液呈碱性,可选用甲基橙或酚酞做指示剂
D.溶液呈碱性,只能选用酚酞做指示剂
难度: 简单查看答案及解析
-
常温下,已知0.1mol/L的NaX、NaY、NaZ溶液,其pH值分别8、9、10,则HX、HY、HZ的酸性强弱排列正确的是( )
A. HX>HY>HZ B.HY>HX>HZ
C. HZ>HY>HX D.HZ>HX>HY
难度: 简单查看答案及解析
-
下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7;
②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应;
④常温下0.1mol/L的HF溶液的pH为2.3;
⑤HF能与Na2CO3溶液反应,产生CO2气体;
⑥HF与水能以任意比混溶;
⑦1mol/L的HF水溶液能使紫色石蕊试液变红。
A.①②⑦ B.②③⑤ C.③④⑥ D.①④
难度: 简单查看答案及解析
-
某温下,重水(D2O)的离子积为1.6×10-15,若用pH一样地定义pD,则该温下关于pD叙述正确的是:
A、纯重水中pD=7
B1L溶有0.01molNaOD的D2O溶液中,溶液的pD=12
C、1L溶有0.01molDCl的D2O溶液中,溶液的pD=2
D、在100mL0.25mol/LNaOD的的重水中,加入50mL0.2mol/L的DCl的重水溶液,其pD=1
难度: 简单查看答案及解析
-
中和相同体积、相同pH的Ba(OH)2、NaOH、NH3·H2O三种溶液,所用相同浓度的盐酸的体积分别是V1、V2、V3,则三者的关系是:( )
A、V1=V2=V3 B、V1>V2>V3
C、V3>V1>V2 D、V1=V2<V3
难度: 简单查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
难度: 简单查看答案及解析
-
向体积均为1 L、pH均等于2的盐酸和醋酸中,分别投入0.28 g Fe,则下图中的曲线符合反应事实的是( )
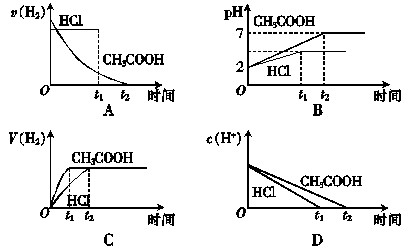
难度: 简单查看答案及解析
-
化合物HIn在水溶液中因存在电离平衡 HIn(溶液)(红色)
H+(溶液)+In-(溶液)(黄色) ,故可用作酸碱指示剂。
浓度为0.02 mol·L-1的下列各溶液①盐酸②石灰水③NaCl溶液
④NaHSO4溶液⑤NaHCO3溶液⑥氨水,其中能使指示剂显红色的是:
A. ①④⑤ B. ②⑤⑥ C. ①④ D. ②③⑥
难度: 简单查看答案及解析
-
常温下PH=2的A酸溶液和PH=12的B碱溶液等体积混合后,溶液的PH一定小于7,则A、B可能为( )
A.强酸、强碱 B.弱酸、弱碱 C.强酸、弱碱 D.弱酸、强碱
难度: 简单查看答案及解析
-
0.01mol·LH2SO4滴定0.01mol·L-1NaOH溶液,中和后加水至100ml.若滴定时终点判断有误差:
①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05ml),则①和②[H+]之比是( )
A.10 B.50 C.5×103 D.104
难度: 简单查看答案及解析
-
下列溶液加热蒸干后,能析出溶质固体的是
A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4HCO3
难度: 简单查看答案及解析
-
室温下,某无色透明溶液中由水电离出来的H+和OH—浓度的乘积为1×10—24,则此溶液中可能大量共存的离子组为( )
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
难度: 简单查看答案及解析
-
物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
A.NH4Cl B.NH4HSO4 C.CH3COONH4 D.NH4HCO3
难度: 简单查看答案及解析
-
将0.1mol/LNaOH和0.1mol/LNH4CI溶液等体积混合后,离子浓度大小正确的次序是:
A C(Na+)>C(CI-)>C(OH-)>C(H+)
B、C(Na+)=C(CI-)>C(OH-)>C(H+)
C、C(Na+)=C(CI-)>C(H+)>C(OH-)
D、C(CI-)>C(Na+)>C(OH-)>C(H+)
难度: 简单查看答案及解析
-
下列实验操作和数据记录都正确的是
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,称得质量为10.2 g
B.用50 mL酸式滴定管量取KOH溶液,体积为36.60 mL
C.用湿润的pH试纸测稀盐酸溶液的pH,pH=3.52
D.用10 mL量筒粗略量取NaCl溶液,体积为9.2 mL
难度: 简单查看答案及解析
-
在pH = 3的FeCl3溶液和pH = 3的盐酸中,由水电离出来的H+的浓度分别为C1、C2,pH = 11的Na2CO3溶液中水电离出来的OH
的浓度为C3 , 则它们之间的关系是
A. C1<C2<C3 B. C1=C3>C2 C. C1>C2>C3 D. 无法判断
难度: 简单查看答案及解析
-
25℃时,amol/L稀盐酸与bmoL/L稀氢氧化钠溶液等体积混合后,所得溶液的pH=12(混合液的总体积可视为原两种溶液体积相加),则a和b的关系为( )。
A.a=b/2 B.b=a+0.02 C.a=b+0.02 D. a=b+0.01
难度: 简单查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.
B.
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
难度: 简单查看答案及解析
-
.M和N两溶液分别含有下列十二种离子中的五种和七种离子: K+、Na+、H+、NH4+、 Fe3+、Al3+、Cl-、OH-、NO3-、S2-、CO32-、SO42-。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是 ( )
A.OH-、CO32-、SO42- B.S2-、Cl-、SO42-
C.CO32-、NO3-、S2- D.Cl-、SO42-、NO3-
难度: 简单查看答案及解析