-
化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A. 氯气作水杀菌消毒剂 B. 氦气可用于填充飞艇
C. 二氧化硫作纸浆的漂白剂 D. 肥皂水作蚊虫叮咬处的淸洗剂
难度: 简单查看答案及解析
-
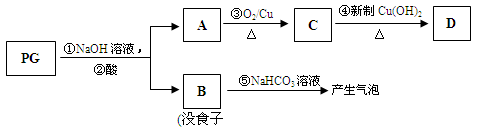
苯乙烯的结构为
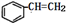 ,该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有( )
,该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有( )A. 4种 B. 5种 C. 6种 D. 7种
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA
B. 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
C. Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA
D. 14g分子式为C3H6的链烃中含有的C-H鍵的数目为2NA
难度: 中等查看答案及解析
-
甲酸香叶脂(结构如图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精。下列有关该有机物的叙述正确的是
A. 分子式为C11H18O2 B. 含有羧基和碳碳双键两种官能团
C. 能发生加成反应和水解反应 D. 23gNa与过量的该物质反应生成标准状况下11.2L气体
难度: 中等查看答案及解析
-
某种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是

A. 电极A为正极
B. 电池工作时,CO32-向电极B移动
C. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 中等查看答案及解析
-
下列说法正确的是
A. pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:c(NH4+)> c(Cl-) > c(OH-) > c(H+)
B. 升高NH4Cl溶液的温度,其水的离子积常数和pH均增大
C. 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,則该反戍的△H>0
D. 常温下0.1mol/L的Na2A溶液pH=10,该溶液中水电离的c(OH-)=10-10mol/L
难度: 困难查看答案及解析
-
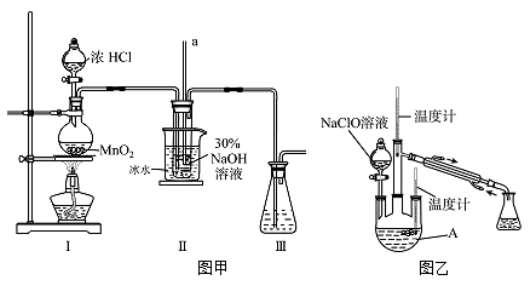
巧妙的实验设计冇助于更好地解决问题,下列装置不能达到实验目的的是
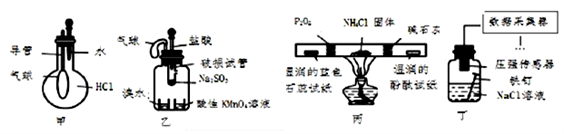
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙可以验证SO2具有漂白性
C. 用装置丙检验NH4Cl分解产生的气体
D. 用装置丁采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
难度: 中等查看答案及解析
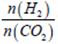 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)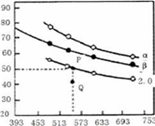
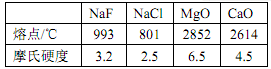
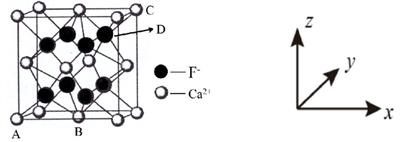
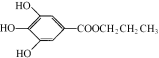 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。