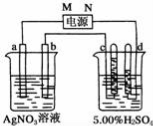
-
既能用来鉴别甲烷与乙烯,又能用来除去甲烷中的乙烯以提纯甲烷的方法是
A.通过足量的NaOH溶液 B.通过足量的溴水
C.在Ni催化、加热条件下通入H2 D.通过足量的酸性KMnO4溶液
难度: 中等查看答案及解析
-
下列关于乙醇的说法中,不正确的是
A.乙醇是无色透明、有特殊香味的液体 B.乙醇可以使酸性高锰酸钾溶液褪色
C.乙醇属于烃类物质 D.无水硫酸铜常用于检验乙醇中是否含有水
难度: 中等查看答案及解析
-
下列关于戊烷的说法正确的是
A.分子中的碳原子在一条直线上 B.其一氯代物共有8种
C.能与溴水发生取代反应 D.同分异构体有2种
难度: 中等查看答案及解析
-
下列化学变化属于加成反应的是
A.乙醇在铜作催化剂的条件下加热和空气的反应
B.乙烯通入溴的四氯化碳溶液中的反应
C.甲烷在光照条件下与氯气发生的反应
D.苯与液溴在铁粉作催化剂的条件下发生的反应
难度: 简单查看答案及解析
-
人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代。以下说法正确的是
A.原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动
B.目前我国广大农村生活做饭使用的都是氢能源
C.多能源时代指的是新能源时代,包括核能、太阳能、氢能
D.化石燃料的燃烧没有污染
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法不正确的是
A.乙烯可用作水果的催熟剂
B.二氧化硫可用作食品的漂白剂
C.交警可用酸性重铬酸钾来检测司机是否酒驾
D.黄铜(铜锌合金)制作的铜锣不易产生铜绿
难度: 简单查看答案及解析
-
关于元素周期表的说法中正确的是
A. 元素周期表有8个主族 B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期 D. 短周期是指第一、二周期
难度: 简单查看答案及解析
-
下列关于金属冶炼的说法正确的是
A.金属Mg只能用热还原法制备 B.高炉炼铁的原理是用CO还原铁矿石
C.电解AlCl3制金属Al D.用热还原法制金属Na
难度: 简单查看答案及解析
-
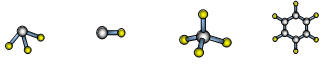
下列化学用语的书写正确的是
A.CO2的比例模型: B.氮气的电子式:
C.S原子结构示意图:
D.8个中子的碳原子的符号:12C
难度: 中等查看答案及解析
-
下列性质的比较正确的是
A. 酸性:H2SiO3>H2CO3 B. 碱性:Mg(OH)2>Al(OH)3
C. 稳定性:SiH4>PH3 D. 原子半径:N>C
难度: 中等查看答案及解析
-
下列关于原电池的说法不正确的是
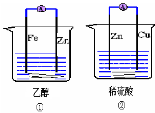
A.①②装置都能将化学能转化为电能
B.②中的硫酸根离子向负极移动
C.②中的电子由Zn流向Cu
D.②中电流的方向是由正极到负极
难度: 简单查看答案及解析
-
下列反应中属于放热反应的是
A.Al与盐酸的反应 B.灼热的炭与二氧化碳反应生成一氧化碳
C.石灰石受热分解 D.水分解生成氧气和氢气
难度: 简单查看答案及解析
-
下列有关化学键的叙述,正确的一项是
A.离子化合物中一定含有离子键 B.单质的分子中均不存在化学键
C.含有共价键的化合物一定是共价化合物 D.任何物质内都含有化学键
难度: 中等查看答案及解析
-
锌粒和盐酸反应一段时间后,反应速率减慢。此时加热或加入浓盐酸,反应速率明显加快。上述实验中影响化学反应速率的因素有
①温度 ②固体的表面积 ③反应物的状态 ④溶液的浓度 ⑤催化剂
A.①④ B.①③ C.②④ D.①②③④⑤
难度: 中等查看答案及解析
-
对CH4与Cl2的反应(如右图所示)叙述不正确的是

A.该反应属于取代反应
B.该反应的条件是光照
C.该反应的生成物有四种
D.该反应现象是量筒内气体颜色变浅,器壁上有油状液滴,量筒内液面上升并产生白雾
难度: 中等查看答案及解析
-
某原电池总反应的离子方程式是: Zn+Cu2+===Zn2++Cu,依据此反应设计原电池的正确组合是
选项
正极
负极
电解质溶液
A
Cu
Zn
稀盐酸
B
C
Zn
硫酸铜溶液
C
Zn
Cu
氯化铜溶液
D
Zn
Cu
硝酸铜溶液
难度: 简单查看答案及解析
-
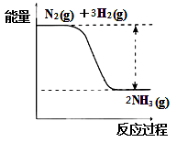
已知反应:X+Y=M+N为放热反应,则下列说法正确的是
A.断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量
B.X和Y的总能量一定高于M和N的总能量
C.Y的能量一定高于N
D.因为该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
恒温下,在体积恒定的密闭容器中发生可逆反应:2SO2 (g)+ O2 (g)
2SO3(g),下列不能用来判断该反应达到平衡状态的是
A.容器中压强不再变化
B.SO2的体积分数不再变化
C.容器中各物质的浓度不再变化
D.单位时间内生成SO2的物质的量与消耗SO3的物质的量相等
难度: 简单查看答案及解析
-
下列说法正确的是
A. C与Si位于同一主族,且干冰与SiO2都是酸性氧化物 ,所以二者晶体类型相同
B. NaCl和AlCl3均为强电解质,二者在熔融状态下都能导电
C. 从晶体类型上来看物质的熔沸点,其规律是:原子晶体>离子晶体>分子晶体
D. 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
难度: 简单查看答案及解析
-
若nA代表阿伏加德罗常数,下列表述正确的是
A.标准状况下,11.2L NH3中含共价键的数目为1.5nA
B.均含nA个氧原子的氧气和臭氧的质量比为3: 2
C.1.8克D2O中含有nA个中子
D.过氧化钠与水反应转移nA个电子时,产生氧气的体积在标准状况下为22.4L
难度: 简单查看答案及解析
-
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随时间的变化如下图所示,下列判断正确的是
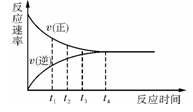
A.t1时刻,v(正)<v(逆)
B.t2时刻,v(正)>v(逆)
C.t3时刻,v(正)=v(逆)
D.t4时刻,v(正)<v(逆)
难度: 中等查看答案及解析
-
将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:2A(g) + B(g) = 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
A.用物质A表示的反应速率为0.6mol/(L·s)
B.用物质B表示的反应速率为0.3mol/(L·s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.3mol/L
难度: 简单查看答案及解析
-
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大。X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层电子数与其电子层数相等,Z-与M2+具有相同的核外电子层结构。下列推测正确的是
A. 原子半径Y>Z,离子半径Z-<M2+
B. MX2与水发生反应时,MX2只做氧化剂
C. X、Y形成的化合物既能与强酸反应又能与强碱反应
D. MX2、MZ2两种化合物中,阳离子与阴离子个数比均为1:2
难度: 简单查看答案及解析
-
通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热。下列是一些化学键的键能。
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol
)
414
489
565
155
根据键能数据估算反应CH4+4F2=CF4+4HF每消耗1mol CH4的热效应
A.放热1940 kJ B.吸热1940 kJ
C.放热485 kJ D.吸热485 kJ
难度: 简单查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:
CH3CH2OH– 4e—+ H2O = CH3COOH + 4H+。下列有关说法正确的是
A.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O
B.检测时,电解质溶液中的 H+向负极移动
C.若有 0.4 mol 电子转移,则在标准状况下消耗 4.48 L 氧气
D.正极上发生的反应为:O2 + 4e—+ 2H2O = 4OH—
难度: 简单查看答案及解析