-
容量瓶上需标有:①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式;六项中的
A.①③⑤ B.③⑤⑥ C.①②④ D.②④⑥
难度: 简单查看答案及解析
-
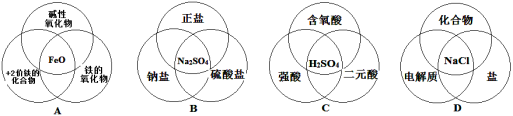
下列说法中正确的是
A.纯净物一定由分子构成
B.由同种分子构成的物质一定是纯净物
C.混合物肯定是由两种以上的元素组成的
D.含有氧元素的化合物就是氧化物
难度: 中等查看答案及解析
-
下列物质在水溶液中的电离方程式正确的是
A.NaHSO4===Na++ HSO4- B.Al2(SO4)3===2Al3++3SO42-
C.NH4Cl===NH3 + H++Cl- D.H2CO3===2H++CO32-
难度: 中等查看答案及解析
-
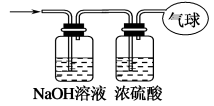
下列图示不正确的是
难度: 中等查看答案及解析
-
在下列溶液中Cl- 的物质的量浓度最大的是
A.0.5L 0.1mol/L的NaCl溶液 B.100mL 0.2mol/L的MgCl2溶液
C.1L 0.2mol/L的AlCl3溶液 D.1L 0.3mol/L盐酸溶液
难度: 中等查看答案及解析
-
下列有关实验操作正确的是
A.蒸馏实验中温度计的水银球应插入液态混合物中
B.用酒精萃取碘水中的碘
C.分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出
D.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯
难度: 中等查看答案及解析
-
离子方程式H++OH-===H2O所表示的反应是
A.所有酸和碱之间的中和反应
B.所有强酸和强碱之间的中和反应
C.所有可溶性酸和可溶性碱的反应
D.强酸与强碱生成可溶性盐和水的反应
难度: 中等查看答案及解析
-
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
A.用CCl4提取溴水中的Br2
B.从KI和I2的固体混合物中回收I2
C.稀释浓硫酸
D.工业酒精制备无水酒精
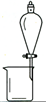
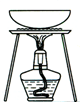
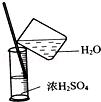
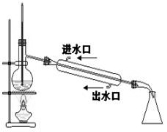
难度: 中等查看答案及解析
-
实验室制取氧气的反应为2KClO3
2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
A.溶解、过滤、蒸发、洗涤 B.溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤 D.溶解、洗涤、过滤、加热
难度: 中等查看答案及解析
-
下列反应完成后有沉淀生成的是
A.BaCl2溶液与Na2CO3溶液加足量CH3COOH溶液
B.Ba(OH)2溶液与KNO3溶液加足量稀硫酸
C.AgNO3溶液与Na2CO3溶液加足量稀硝酸
D.Ca(OH)2溶液与FeCl3溶液加足量稀硝酸
难度: 中等查看答案及解析
-
相等物质的量的H2O和H2O2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1
②它们所含的原子总数目之比为3∶4
③它们所含的O原子数目之比为1∶2
④它们所含的H原子数目之比为1∶1
⑤它们所含的质子数目之比为5∶9
A、①②③ B、③④⑤ C、①②④ D、①②③④⑤
难度: 中等查看答案及解析
-
下列常见现象与胶体无关的是
A.清晨在密林中看到一缕缕的光束
B.向豆浆中加入硫酸钙使蛋白质等聚沉,制成可口的豆腐
C.FeCl3溶液加入NaOH溶液产生红褐色沉淀
D.利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上
难度: 中等查看答案及解析
-
下列离子方程式中,只能表示一个化学反应的是
①CO32-+2H+===CO2↑+H2O
②Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
③Ag++Cl-===AgCl↓
④Fe+Cu2+===Fe2++Cu
⑤Cl2+H2O===H++Cl-+HClO
A.①③ B.②④ C.②⑤ D.只有⑤
难度: 中等查看答案及解析
-
实验室需配置一种仅含四种离子(不考虑水电离出来的离子)的无色混合溶液,且在混合物溶液中四种离子的浓度均为1mol/L。下列四个选项中能达到此目的的是
A.Na+、K+、SO42-、Cl- B.Cu2+、K+、SO42-、NO3-
C.H+、K+、HCO3-、Cl- D.Mg2+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是
A.石灰水和稀盐酸混合
B.小苏打溶液和柠檬水混合
C.人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合
D.氯化钠溶液和蔗糖水混合
难度: 中等查看答案及解析
-
FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是
A.Fe(OH)3胶体区别于其它分散系的本质特征是分散质粒子的直径在10-9~10-7米之间
B.分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应
C.三种分散系的颜色都相同,且均能与盐酸反应,具有吸附性
D.三种分散系中分散质均属于电解质
难度: 中等查看答案及解析
-
若NA代表阿伏加德罗常数的值,下列说法正确的是
A.等物质的量的N2与O2中的所含分子数均为NA
B.标准状况下,5.6L CCl4含有的分子数为0.25NA
C.常温常压下,22gCO2含有的原子数为1.5NA
D.1mol/L NaOH溶液中含有的Na+的数目为NA
难度: 中等查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量小
C.甲的气体摩尔体积比乙的气体摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
难度: 中等查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A.向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32-
B.向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液中一定有Ag+
C.向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有SO42-
D.向某溶液中加入加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+
难度: 中等查看答案及解析
-
在标准状况下,称量一个充满氯气的容器质量为74.6g,若改充氮气,其质量为66g,则容器的容积为
A.11.2L B.5.6L C.4.48L D.2.24L
难度: 中等查看答案及解析
-
某物质A在一定条件下加热完全分解,产物都是气体,分解方程式为:2A=B+C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为
A.7d B.4d C.2.5d D.2d
难度: 中等查看答案及解析
-
将15g两种金属的混合物投入足量的盐酸中,反应完全后得到11.2L H2 (标准状况),该混合物的组成可能是
A.钠和铁 B.镁和铜 C.铝和镁 D.锌和铁
难度: 中等查看答案及解析