-
下列物质的分子中,共用电子对数目最多的是
A、N2 B、NH3 C、CO2 D、H2O
难度: 简单查看答案及解析
-
下列含有非极性键的共价化合物是
A、HCl B、Na2O2 C、C2H6 D、CH4
难度: 简单查看答案及解析
-
下列叙述中,不正确的是
A、最外层1个电子的原子不一定是IA族元素
B、过渡元素均为金属元素
C、最外层3-7个电子的原子一定是主族元素
D、最外层有2个电子的最高正价一定为+2价
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A、金属性越强,其最高价氧化物对应水化物的碱性越强
B、金属性越强,等物质的量单质与足量的酸反应生成的氢气越多
C、金属性越强,其单质晶体的熔点越高
D、金属性越强,其对应的阳离子的氧化性越强
难度: 简单查看答案及解析
-
下列各组物质中,化学键类型完全相同的是
A、SO2和Na2O2 B、CO2和H2O C、NaCl和HCl D、CCl4和KCl
难度: 简单查看答案及解析
-
下列性质中,可以证明某化合物内一定存在离子键的是
A、可溶于水 B、具有较高的熔点
C、水溶液能导电 D、熔融状态能导电
难度: 简单查看答案及解析
-
NaH是一种离子化合物,它跟水反应的方程式为:NaH+H2O=NaOH+H2↑,它也能跟乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A、跟水反应时,作氧化剂
B、NaH中H-离子半径比Li+半径小
C、与水反应添加Al或Si,可增加生成氢气量
D、跟乙醇反应时,NaH被氧化
难度: 简单查看答案及解析
-
下列化合物中离子核间距最大的是
A、NaCl B、KI C、KF D、LiI
难度: 简单查看答案及解析
-
相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。下列关系中正确的是
A、2E1=E2 B、2E1>E2 C、2E1<E2 D、E1=E2
难度: 简单查看答案及解析
-
已知mRn—阴离子的原子核内有x个中子,则ω克mRn—阴离子中含有的电子的物质的量为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
共价键、离子键和范德华力都是微粒间的作用力,下列物质:①Na2O2;②SiO2;③石墨;④金刚石;⑤CaH2;⑥白磷,其中含有两种结合力的组合是
A、①③⑤⑥ B、①③⑥ C、②④⑥ D、①②③⑥
难度: 简单查看答案及解析
-
下列物质的熔点或液化温度由高到低顺序的是
A、金刚石>晶体硅>碳化硅 B、CF4>CCl4>CBr4
C、NH3>N2>H2 D、纯镁>镁铝合金>纯铝
难度: 简单查看答案及解析
-
有下列两组命题,其中B组中命题正确,且能用A组命题加以正确解释的是
A组
B组
Ⅰ.H—I键键能大于H—Cl键键能
①HI比HCl稳定
Ⅱ.H—I键键能小于H—C1键键能
②HI比HCl稳定
Ⅲ.HI分子间作用力大于HCl分子间作用力
③HI沸点比HCl高
Ⅳ.HI分子间作用力小于HCl分子间作用力
④HI沸点比HCl低
A、Ⅰ① B、Ⅱ② C、Ⅲ③ D、Ⅳ④
难度: 简单查看答案及解析
-
下列关于C60的说法中,正确的是
A、C60属于原子晶体
B、C60易溶于水
C、C60熔点非常高
D、C60和金刚石互为同素异形体
难度: 简单查看答案及解析
-
下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是
A、食盐和蔗糖熔化 B、钠和硫熔化
C、碘和干冰升华 D、二氧化硅和氧化钠熔化
难度: 简单查看答案及解析
-
下列符号表示的既是化学式又是分子式
A、NaOH B、CsCl C、SO2 D、SiO2
难度: 简单查看答案及解析
-
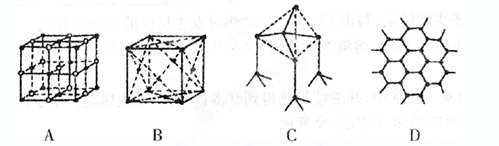
下列各项所述的数字是6的是
A、在金刚石晶体中,最小的环上的碳原子个数
B、在CsCl晶体中,与一个Cs+最近的且距离相等的Cl-的个数
C、在二氧化硅晶体中,与一个硅原子成键的氧原子数
D、在苯分子中,共面的原子总数
难度: 简单查看答案及解析
-
下列数据是对应物质的熔点(单位:℃)
Na2O
NaCl
AlF3
AlCl3
BCl3
Al2O3
CO2
SiO2
920
801
1291
190
-107
2073
-57
1723
据此做出的下列判断中,正确的是 ( )
A、铝的化合物晶体类型完全相同
B、原子晶体的熔点一定比离子晶体高
C、同族元素的氧化物一定形成相同类型的晶体
D、不同族元素的氧化物可形成相同类型的晶体
难度: 简单查看答案及解析
-
下列表示离子、分子或自由基的电子式中,错误的是
A、
B、
C、
D、
难度: 简单查看答案及解析
-
下列变化或数据与氢键无关的是
A、HCl、HBr、HI的沸点逐渐升高
B、常温常压下,氨气在水中的溶解度是1:700
C、对羟基苯甲醛的沸点比邻羟基苯甲醛的高
D、甲酸蒸气的密度在373K,101kPa时为1.335g·L-1,在293K,101kPa时为2.5g·L-1
难度: 简单查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,表示为NA,下列叙述中正确的是
A、31g 白磷分子(P4)中含有P—P键个数为1.5NA
B、常温常压下,22.4L O2和O3的混合气体所含分子数为NA
C、1L 1.0 mol/L氨水中,NH3·H2O的分子数为NA
D、20g 重水(D2O)中含有的中子数为8 NA
难度: 简单查看答案及解析
-
列各组微粒,不能互称为等电子体的是
A、NO2、NO2+、NO2- B、CO2、N2O、N3-
C、CO32-、NO3-、SO3 D、N2、CO、CN-
难度: 简单查看答案及解析
-
对于SO2和CO2的说法中正确的是 ( )
A、都是直线形结构 B、中心原子都采用sp杂化类型
C、SO2为V形结构,CO2为直线形结构 D、S原子和C原子上都没有孤对电子
难度: 简单查看答案及解析