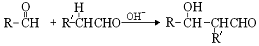-
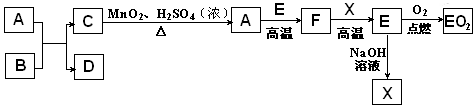
A、B、C、D四种短周期元素,其核电荷数依次增大,已知元素A和D可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍。则下列由四种元素形成的化合物的化学式或结构式不正确的是
A.B2A6CD2 B. C. D.B2A5D2C
难度: 简单查看答案及解析
-
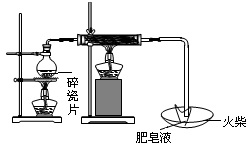
.在实验室做用锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果
序号
锌的质量(g)
锌的形状
温度(℃)
完全溶解于酸的时间(s)
A
2
薄片
5
400
B
2
薄片
15
200
C
2
薄片
25
100
D
2
薄片
30
t1
E
2
薄片[
35
50
F
2
颗粒
15
t2
G
2
粉末
15
t3
①t1=75 ②t2>200>t3 ③单位时间内消耗的锌的质量m(C)>m(B)>m(G)
则下列说法正确的是 ( )
A.①③ B.①② C.只有② D.全部正确
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法中正确的是 ( )
A.标准状况下,1L水中含有的H+ 数目为10-7 NA
B.足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2NA
C.1mol硫酸钾中阴离子所带电荷数为NA
D.14g分子式为CnH2n的(n≥2)烯烃中含有的C=C的数目一定为NA/n
难度: 简单查看答案及解析
-
已知25℃时,0.2mol/L某酸HA 与0.1mol/LNaOH等体积混合,溶液pH>7;含等物质的量的盐NaB和酸HB混合液pH<7。该温度下,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是 ( )
A.c(Na+)>c(OH-)>c(HB)>c(HA) B.c(Na+)>c(OH-)>c(A-)>c(B-)
C.c(Na+)>c(OH-)>c(HA)>c(HB) D.c(OH-)>c(Na+)>c(B-)>c(A-)
难度: 简单查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可采取多种分类方法。如果按某种标准能将FeSO4、NO2、K2MnO4、Cu3P划为一类物质,则下列物质中不能划分为此类物质的是 ( )
A.Na2O2 B.NO C. Al2 (SO4)3 D.NaClO
难度: 简单查看答案及解析
-
将20gM物质、5gN物质、9gP物质混合加热发生化学反应,经充分反应后的混合物中含5gM物质、20gP物质还含有一种新物质Q。若M、N、P、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是 ( )
A.M + N = P + Q B.M + 2N = 2P + Q
C.2M + N =2P + Q D.2M + N = P + 2Q
难度: 简单查看答案及解析
-
新鲜水果、蔬菜、乳制品中富有的维生素C具有明显的抗衰老作用,但易被空气氧化。某校课外小组的同学利用碘滴定法测某橙汁中维生素C的含量,其化学反应原理为: 下列说法正确的是 ( )
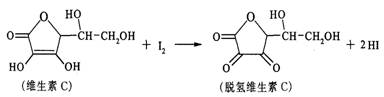
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时视线应注视滴定管中的液面 D.脱氢维生素C的分子式为C6H5O6
难度: 简单查看答案及解析