-
下列条件一定能使反应速率增大的是( )
① 增加反应物的物质的量 ② 升高温度 ③ 缩小反应容器的体积
④ 不断分离出生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.②③ D.②
难度: 中等查看答案及解析
-
用于净化汽车尾气的反应:2NO(g)+2CO(g)
2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为l×1059。下列说法正确的是( )
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570K时该反应正向进行的程度很大,故使用催化剂并无实际意义
难度: 简单查看答案及解析
-
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间内有amolA生成的同时生成3amolB;
③A、B、C的浓度不再变化;
④容积不变的密闭容器中混合气体的总压强不再变化;
⑤混合气体的物质的量不再变化;
⑥单位时间消耗amolA,同时生成3amolB ;
⑦A、B、C的分子数目之比为1:3:2。
A.②⑤ B.②⑦ C.①③ D.⑤⑥
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3
C.加入催化剂有利于氨的合成
D.工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
难度: 中等查看答案及解析
-
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-1025kJ/mol,该反应是一个可逆反应。若反应物
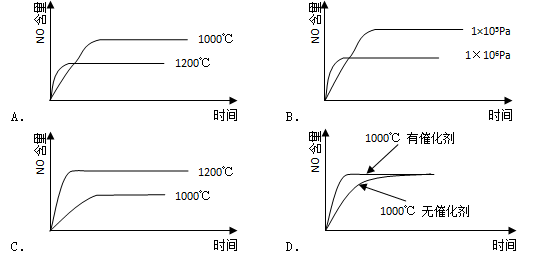
难度: 简单查看答案及解析
-
在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+ N(g)
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol•L-1.下列说法正确的是( )
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8mol•L-1•min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol•L-1
难度: 简单查看答案及解析
-
在容积为2L的容器内,发生反应2A(s)+3B(g)
2C(g)+D(g),起始时充入3molA和2.5molB混合气体;经过5min达到平衡,生成0.5molD,下列说法正确的是( )
A.若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态
B.C的平衡浓度为1mol/L
C.5min内B的平均消耗速率为0.3mol/(L•min)
D.平衡后,增大压强,平衡向正反应方向移动
难度: 简单查看答案及解析
-
加热N2O5,依次发生的分解反应为:①N2O5(g)
N2O3(g)+O2(g), ②N2O3(g)
N2O(g)+O2(g).在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
A.10.7 B.8.5 C.9.6 D.10.2
难度: 简单查看答案及解析
-
在一定条件下,对于反应mA(g)+nB(g)
cC(g)+dD(g), C物质的浓度(c%)与温度、压强的关系如图所示。

下列判断正确的是( )
A.△H<0、△S>0 B.△H>0、△S<0
C.△H>0、△S>0 D.△H<0、△S<0
难度: 中等查看答案及解析
-
下列对化学反应预测正确的是()
选项
化学反应方程式
已知条件
预测
A
M(s)=X(g)+Y(s)
ΔH>0
它是非自发反应
B
W(s)+xG(g)=2Q(g)
ΔH<0,自发反应
x可能等于1、2、3
C
4X(g)+5Y(g)=4W(g)+6G(g)
能自发反应
ΔH一定小于0
D
4M(s)+N(g)+2W(l)=4Q(s)
常温下,自发进行
ΔH>0
难度: 中等查看答案及解析
-
在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是( )
A.再充入2mol A,平衡正移,A的转化率增大
B.如果升高温度,C的体积分数增大
C.如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D.再充入1mol C,C的物质的量浓度将增大
难度: 简单查看答案及解析
-
一定条件下,向一带活塞的密闭容器中充入2molSO2在一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,下列反应:2SO2(g)+O2(g)
2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入1molSO2(g)
B.保持温度和容器内压强不变,充入1molSO3(g)
C.保持温度和容器内压强不变,充入1molO2(g)
D.保持温度和容器内压强不变,充入1molAr(g)
难度: 中等查看答案及解析
-
将pH为5的盐酸溶液稀释500倍,稀释后溶液中c(Cl-)和c(H+)之比约为( )
A.1:2 B.1:5 C.1:10 D.10:1
难度: 中等查看答案及解析
-
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3
NH4++NH2-据此判断以下叙述中错误的是( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
C.液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
难度: 中等查看答案及解析
-
水是一种极弱的电解质,在室温下平均每n个水分子中只有1个水分子发生电离,则n值是( )
A.1×10-14 B.55.6×107 C.107 D.55.6
难度: 中等查看答案及解析
-
已知下面三个数据:①7.2×10 -4 ②2.6×10 -4 ③4.9×10 -10 分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO 2 ==HCN+NaNO 2 NaNO 2 +HF==HCN+NaF NaNO 2 +HF==HNO 2 +NaF
由此可判断下列叙述中正确的是( )
A.HF的电离常数是① B.HNO2 的电离常数是①
C.HCN的电离常数是② D.HNO2 的电离常数是③
难度: 中等查看答案及解析
-
下列溶液一定显酸性的是()
① pH<7的溶液 ② c(H+)=c(OH-)的溶液
③c(H+)=l×10-6mol/L的溶液 ④c(H+)>c(OH-)的溶液
⑤ 25℃下pH=6的溶液 ⑥能使酚酞试液显无色的溶液
A.①③④⑤⑥ B.②④⑤⑥ C.⑤⑥ D.④⑤
难度: 中等查看答案及解析
-
水的电离过程为H2O
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14.则下列叙述正确的是( )
A.c(H+)随温度的升高而降低 B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃) D.35℃时已电离的水的浓度约为2×10-7mol/L
难度: 中等查看答案及解析
-
取pH值均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A.醋酸与锌反应放出氢气多
B.从反应开始到结束所需时间盐酸短
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
难度: 中等查看答案及解析
-
下列有关几种试纸使用的描述中,不正确的是( )
A. 用湿润的红色石蕊试纸检验某种气体是否是NH3
B. 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中可能含有Fe3+
C. 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH
D. 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色
难度: 简单查看答案及解析
-
在甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L的甲酸溶液中c(H+)约为0.01mol/L
B.甲酸与活泼金属反应生成氢气
C.10mL1mol/L的甲酸恰好与10mL1mol/L的NaOH溶液完全反应
D.在相同浓度下,甲酸的导电性比二元强酸溶液的弱
难度: 中等查看答案及解析
-
常温下,将0.1mol/L的氢氧化钠与0.06mol/L硫酸溶液等体积混合,该混合溶液的PH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
难度: 简单查看答案及解析
-
室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应.下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7 D.若x=10y,且a+b=14,则pH>7
难度: 简单查看答案及解析
-
在恒温时,一固定容积的容器内发生如下反应:N2O4(g)
2NO2(g)达到平衡时,再向容器内通入一定量的N2O4(g),重新达到平衡后,与第一次平衡时相比,N2O4的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
难度: 简单查看答案及解析
-
反应mA(s)+nB(g)
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )

①m+n>p
②x点表示的正反应速率大于逆反应速率
③n>p
④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大.
A.①②⑤ B.只有②④ C.只有①③ D.只有①③⑤
难度: 中等查看答案及解析
-
在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g)
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器
甲
乙
丙
丁
起始投料量
2 mol SO2+1 mol O2
1 mol SO2+0.5 mol O2
2 mol SO3
2 mol SO2+2 mol O2
反应放出或吸收的热量(kJ)
a
b
c
d
平衡时c(SO3) (mol·L-1)
e
f
g
h
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
难度: 困难查看答案及解析
-
在容积为2 L的3个密闭容器中发生反应3A(g)+B(g)
xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器
甲
乙
丙
反应物投入量
3 mol A、2 mol B
6 mol A、4 mol B
2 mol C
到达平衡的时间(min)
5
8
A的浓度(mol/L)
c1
c2
C的体积分数
w1
w3
混合气体密度(g/L)
ρ1
ρ2
下列说法正确的是( )
A.若x<4,则2c1<c2
B.若w3=w1,可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol·L-1·min-1
难度: 困难查看答案及解析
-
一定条件下,可逆反应X(g)+3Y(g)=2Z(g)若X.Y.Z起始浓度分别为c1、c2、c3(均不为0),当达到平衡是X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y 和Z的反应速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
难度: 中等查看答案及解析
-
图I 是NO2(g) +CO(g)
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X, Y随X的变化关系曲线如图II所示。

下列有关说法正确的是( )
A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示反应时间,则Y表示的可能是混合气体的密度
D.若X表示温度,则Y表示的可能是CO2的物质的量浓度
难度: 困难查看答案及解析
-
某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。据图判断错误的是( )
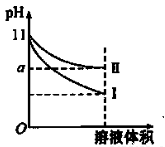
A.a的数值一定大于9
B.II为氨水稀释时溶液的pH变化曲线
C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V( NaOH)<V(氨水)
难度: 简单查看答案及解析
