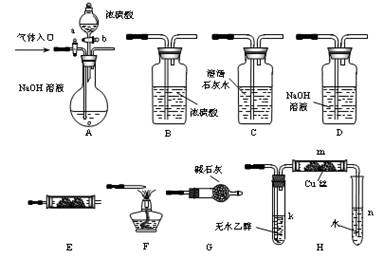
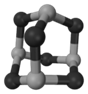-
下列各组中的反应,属于同一反应类型的是( )
A、苯的硝化反应;乙烯使溴水褪色
B、葡萄糖与新制氢氧化铜共热;无水乙醇和浓硫酸共热制乙烯
C、乙醇和乙酸制乙酸乙酯;乙烷和氯气制氯乙烷
D、乙醇和氧气制乙醛;苯和氢气制环己烷
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A、标准状况下,11.2 L氯仿中含有C—Cl键的数目为1.5 NA
B、常温下,42 g丁烯和环丙烷的混合气体中含有的碳碳单键数目为3NA
C、常温下,1 mol SiC中含有Si—C键的数目为4NA
D、常温常压下,17 g甲基(—14CH3)所含的中子数为9 NA
难度: 简单查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A、漂白粉溶液在空气中失效: ClO-+CO2+H2O=HClO+HCO3-
B、用浓盐酸与MnO2反应制取少量氯气: MnO2+2H++2Cl-
Mn2++Cl2↑+2H2O
C、向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO
D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3===2FeO42-+3Cl-+H2O+4H+
难度: 简单查看答案及解析
-
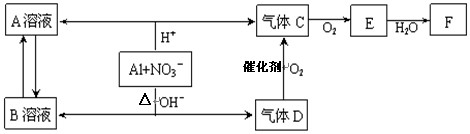
LiAlH4(
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125 ℃分解为LiH、H2和Al。下列说法不正确的是( )
A、LiH与D2O反应,所得氢气的摩尔质量为4 g/mol
B、1 mol LiAlH4在125 ℃完全分解,转移3 mol电子
C、LiAlH4溶于适量水得到无色溶液,化学方程式可表示为:
LiAlH4+2H2O===LiAlO2+4H2↑
D、LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
难度: 简单查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
A、X、M两种元素只能形成X2M型化合物
B、由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C、元素Y、Z、W的单质晶体属于同种类型的晶体
D、元素W和M的某些单质可作为水处理中的消毒剂
难度: 简单查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是:( )
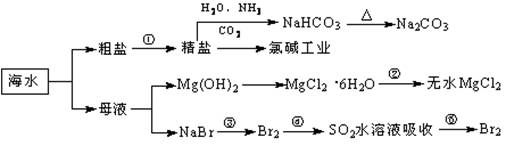
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
难度: 简单查看答案及解析
-
下列溶液中微粒的物质的量关系正确的是( )
A. 将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:
2c(K+)=c(HC2O4-)+c(H2C2O4)
B. pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,
c(NH4+)大小:①=②>③
C. 0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:
c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-)
D. 0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-)
难度: 简单查看答案及解析