-
下列说法存在科学性错误的是( )
A.日本福岛核电站爆炸时释放的2种放射性同位素131I与137Cs的中子数相等
B.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
C.用丁达尔现象可以区分食盐水和淀粉溶液
D.Mg(OH)2和Al(OH)3热分解生成的气态水可覆盖火焰、驱逐O2、稀释可燃气体,分解产物MgO和Al2O3能较快地与塑料燃烧过程中产生的酸性及腐蚀性气体反应,所以它们可以作为未来发展方向的无机阻燃剂难度: 中等查看答案及解析
-
常温下,甲溶液由50mL 0.1mol/L氨水(pH=11)和50mL水混合而成,乙溶液由50mL 0.1mol/L氨水和50mL 0.1mol/L NH4Cl溶液混合而成.下列判断错误的是( )
A.甲溶液的pH:10<pH(甲)<11
B.乙溶液的pH:7<pH(乙)<11
C.乙溶液中:c(NH4+)+c=c(Cl-)
D.甲、乙两溶液中分别加入0.2gNaOH后:pH(甲)>pH(乙)难度: 中等查看答案及解析
-
化学平衡常数(K)、弱酸的电离常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离常数Ka变小
C.KSP(AgCl)>KSP(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生
D.Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,氢氰酸的酸性比醋酸强难度: 中等查看答案及解析
-
下列说法正确的是( )
A.中和热测定实验中以环形铜丝代替环形玻璃搅拌棒会使测定值比理论值偏高
B.除去溴乙烷中溶解的溴,先用足量NaHSO3溶液洗涤,再用蒸馏水洗涤分液
C.反应N H3(g)+HCl(g)=NH4Cl(s)△H<0在任何条件下均能自发进行
D.用标准的盐酸溶液滴定含甲基橙的氢氧化钠溶液,终点时溶液由橙色变成黄色难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.NaAlO2溶液中通入少量二氧化碳:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
B.碳酸镁和盐酸混合:CO32-+2H+═CO2↑+H2O
C.NaClO溶液与FeCl2 溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO
D.高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O难度: 中等查看答案及解析
-
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
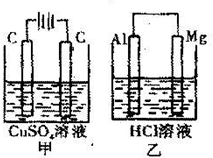
A.溶液的质量变化:甲减小乙增大
B.溶液pH值变化:甲减小乙增大
C.电极反应式:甲中阴极:Cu2++2e-=Cu乙中负极:Mg-2e-=Mg2+
D.相同条件下产生气体的体积:V甲=V乙难度: 中等查看答案及解析