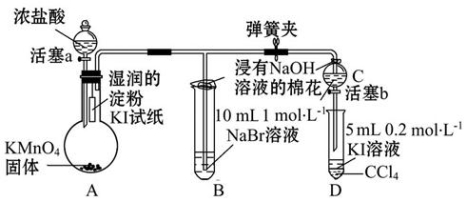
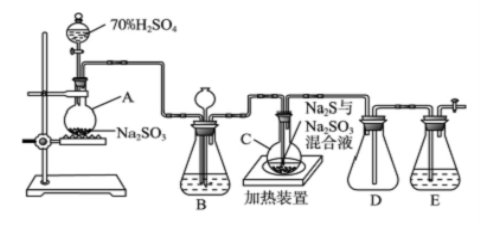
-
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指
A.氨水 B.卤水 C.醋 D. 硝酸
难度: 简单查看答案及解析
-
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.福尔马林、水玻璃、氨水均为混合物
难度: 中等查看答案及解析
-
三个相同的恒温恒容密闭容器中分别盛有等质量的H2、CH4、O2,下列说法正确的是
A.三种气体的分子数目一定相等
B.三种气体物质的量之比为16∶2∶1
C.三种气体的密度之比为1∶2∶1 6
D.三种气体的压强一定相等
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数,下列说法正确的是
A.18gD2O和18gH2O中含有的质子数均为10NA
B.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.欲配制1.00L 1.00mol·L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 将SO2通入酸性高锰酸钾溶液中,溶液褪色,不能说明SO2具有漂白性
B. 浓盐酸和浓硫酸暴露在空气中浓度都会降低,其原因相同
C. 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42-
D. 土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
难度: 中等查看答案及解析
-
下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3
2KCl+3O2↑
C.2KMnO4
K2MnO4+MnO2+O2↑
D.2H2O
2H2↑+O2↑
难度: 中等查看答案及解析
-
从海带中提取碘的实验过程中,涉及下列操作,其中正确的是
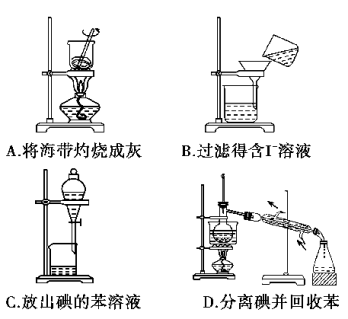
难度: 中等查看答案及解析
-
甲、乙两溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO
、OH-6种离子中的3种,已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
A.K+、OH-、CO
B.Cu2+、H+、Cl-
C.K+、H+、Cl-
D.CO
、OH-、Cl-
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A.
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B.
将铜粉加1.0mol·L-1Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C.
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液
先有白色沉淀生成后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
难度: 中等查看答案及解析
-
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO
B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
C.0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl-
D.0.1 mol·L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO
难度: 中等查看答案及解析
-
无色的混合气体甲,可能含有NO、CO2、NO2、NH3、N2中的某几种。将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为

A.NH3、NO、CO2 B.NH3、NO2、N2
C.NH3、NO2、CO2 D.NO、CO2、N2
难度: 中等查看答案及解析
-
在一密闭容器中有HCHO、H2和O2混合气体共10 g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重4 g,则原混合气体中O2的质量分数是
A.40% B.33.3% C.60% D.36%
难度: 中等查看答案及解析
-
利用下图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
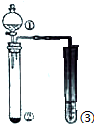
A
稀硫酸
Na2S
AgNO3与AgCl的浊液
Ksp(AgCl)>Ksp(Ag2S)
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
难度: 中等查看答案及解析
-
取4.6 g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生4480 mL的 NO2气体和336 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.26g C.8.51g D.7.04g
难度: 困难查看答案及解析