-
同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是: HXO4>H2YO4>H3ZO4,则下列判断错误的是
A. 原子半径:X > Y > Z B. 气态氢化物的稳定性:HX > H2Y > ZH3
C. 非金属性:X > Y > Z D. 阴离子的还原性:Z3-> Y2-> X-
难度: 中等查看答案及解析
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和C+离子的电子层结构相同,d与b同族。下列叙述错误的是()
A. a与其他三种元素形成的二元化合物中其化合价均为+1
B. b与其他三种元素均可形成至少两种二元化合物
C. c的原子半径是这些元素中最大的
D. d和a形成的化合物的溶液呈弱酸性
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A. 用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
B. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C. 在稀氨水中通入过量CO2:NH3·H2O+CO2===NH4++HCO3-
D. 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-===CaSO4↓+H2O
难度: 简单查看答案及解析
-
下列反应中硝酸既能表现出酸性又表现出氧化性的是( )
A. 使石蕊试液变红
B. 与铜反应放出NO气体,生成Cu(NO3)2
C. 与Na2CO3反应放出CO2气体,生成NaNO3
D. 与S单质混合共热时生成H2SO4和NO2
难度: 中等查看答案及解析
-
下列有关铜与浓硝酸反应的说法中错误的是
A. HNO3是氧化剂,NO2是还原产物
B. 若2 mol HNO3被还原,则反应中一定生成22.4 L NO2气体
C. 参加反应的硝酸中,被还原和未被还原的硝酸的物质的量之比是1∶1
D. 硝酸在反应中既表现了强氧化性,又表现了酸性
难度: 困难查看答案及解析
-
为检验一种氮肥的成分,某学习小组的同学进行了以下实验:
①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。
②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。
由此可知该氮肥的主要成分是
A. NH4HCO3 B. NH4Cl
C. (NH4)2CO3 D. NH4NO3
难度: 中等查看答案及解析
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A. 元素的非金属性次序为c>b>a
B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物
D. 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 困难查看答案及解析
-
最近我国“人造太阳”研究获重大进展。核聚变中下列质子数小于中子数的原子是( )
A. H B. H C. He D. H
难度: 简单查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于
的叙述错误的是
A. 原子序数116 B. 中子数177
C. 核外电子数116 D. 相对原子质量293
难度: 中等查看答案及解析
-
X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
A. 原子序数X<Y B. 原子半径X>Y
C. 原子的最外层电子数X>Y D. 元素的最高正价X<Y
难度: 中等查看答案及解析
-
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子,下列有关这两种粒子的说法不正确的是 ( )
A. “四中子”不显电性
B. “四中子”的质量数为4,其质量比氢原子大
C. 第二种粒子是氧元素的另一种同位素
D. 第二种粒子的化学式为O4,与O2互为同素异形体
难度: 中等查看答案及解析
-
下列事实不能作为实验判断依据的是
A. 钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg
B. 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Cu>Na
C. 酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱:S>C
D. F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl
难度: 困难查看答案及解析
-
下列关于氨水的叙述正确的是
A. 氨水显碱性,是因为氨水是一种弱碱
B. 氨水和液氨成分相同
C. 氨水中物质的量浓度最大的粒子是NH3·H2O(除水外)
D. 氨水中共有五种粒子
难度: 简单查看答案及解析
-
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
A. HNO3、浓硫酸、HClO都具有强氧化性,都是氧化性酸
B. SO3、Na2O、Cl2的水溶液都能导电,但其本身都属于非电解质
C. 漂白粉、福尔马林、胆矾、冰水、王水、氯水都含多种物质,均为混合物
D. HCOOH、H2SO3、H2C2O4分子中均含有两个氢原子,都是二元酸
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.
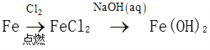
B.
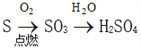
C.
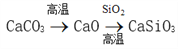
D.
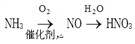
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表:
元素代号
K
L
M
Q
R
T
N
原子半径/nm
0.183
0.160
0.143
0.102
0.089
0.074
0.152
主要化合价
+1
+2
+3
+6、
-2
+2
-2
+1
下列叙述正确的是 ( )
A. K、L、M三元素的金属性逐渐增强
B. 在化合物NCl中,各原子均满足最外层8电子的稳定结构
C. Q元素的最高价氧化物为电解质,其水溶液能够导电
D. K在T单质中燃烧所形成的化合物中含有共价键和离子键
难度: 困难查看答案及解析
-
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶管的胶头,下列与实验事实不相符的是 ( )

A. NH3(H2O含石蕊) 蓝色喷泉 B. HCl (H2O含石蕊) 红色喷泉
C. C12(饱和食盐水) 无色喷泉 D. CO2(NaOH溶液) 无色喷泉
难度: 中等查看答案及解析
-
用下列装置进行实验,能达到相应实验目的的是( )
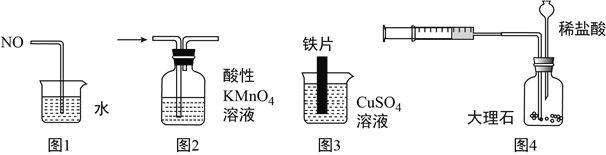
A. 图1可用于吸收多余的NO
B. 图2可用于检验SO2的漂白性
C. 图3可用于比较Fe与Cu的金属活动性强弱
D. 图4可用于测定CO2的生成速率
难度: 简单查看答案及解析
-
在某100 mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4 mol·L−1、0.2 mol·L−1。向该混合液中加入1.92 g铜粉,加热,待充分反应后(假设反应前后溶液体积不变),所得溶液中的Cu2+的物质的量浓度(mol·L−1)是( )
A. 0.15 B. 0.225 C. 0.3 D. 0.45
难度: 中等查看答案及解析
-
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍。下列说法正确的是 ( )

A. 原子半径大小顺序为r(Q)>r(R)>r(T)>r(M)>r(W)
B. Q、W的单核离子的核外电子数相等
C. 五种元素均能形成氢化物
D. W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强
难度: 中等查看答案及解析
-
原子序数大于4的主族元素X、Y的离子
、
核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数
B. X、Y的核电荷数之差是(m-n)
C. Y元素的族序数与X元素的族序数之差是8-(m+n)
D. X和Y处于同一周期
难度: 简单查看答案及解析

