-
下列过程一定释放能量的是
A.化合反应 B.分解反应 C.原子组成分子 D.分子拆成原子
难度: 简单查看答案及解析
-
下列各项与反应热的大、小无关的是
A.反应物和生成物的状态 B.反应物量的多少
C.反应物的性质 D.反应热的单位
难度: 简单查看答案及解析
-
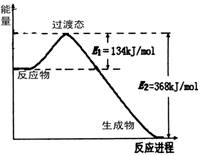
下图为某反应的焓变示意图,下列有关该反应的说法中正确的是
A.△H>0
B.X能量一定高于M
C.该反应为放热反应
D.该反应一定不必加热就可以发生
难度: 简单查看答案及解析
-
某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是
A.铁 B.铜 C.铝 D.镁
难度: 简单查看答案及解析
-
下列各组物质的燃烧热相等的是
A.碳和一氧化碳 B.1 g碳和2 mol碳
C.淀粉和纤维素 D.3 mol乙炔(C2H2)和1 mol苯(C6H6)
难度: 简单查看答案及解析
-
90 ℃时水的离子积KW=3.8×10-13,该温度时纯水的pH是
A.等于7 B.小于7 C.大于7 D.无法确定
难度: 简单查看答案及解析
-
关于如图所示装置的叙述,正确的是
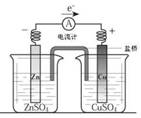
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.铜离子在铜片表面被还原
难度: 简单查看答案及解析
-
下图有关电化学的示意图正确的是

A. B. C. D
难度: 简单查看答案及解析
-
常温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-26,则下列各组离子在该溶液中一定可以大量共存的是
A.K+、Na+、AlO2-、Cl- B.Na+、Cl-、SO42-、HCO3-
C.NH4+、Fe3+、NO3-、SO42- D.Ba2+、Na+、Cl-、NO3-
难度: 简单查看答案及解析
-
下列离子方程式不正确的是
A.氯化铁溶于水:Fe3++3H2O=Fe(OH)3+3H+
B. NaOH溶液与盐酸反应:H++OH-=H2O
C.Cl2气通入烧碱溶液中:Cl2+2OH-=Cl-+ClO-+H2O
D.Na投入大量水中:2Na+2H2O=2Na++2OH-+H2↑
难度: 简单查看答案及解析
-
下列说法中正确的是
A.能够使甲基橙呈现黄色的溶液一定是碱性溶液
B.凡需加热的反应一定是吸热反应
C.水解反应是放热反应
D.绝对不溶解的物质是不存在的
难度: 简单查看答案及解析
-
25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
难度: 简单查看答案及解析
-
反应2SO2+O2
2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为
A.0.1s B.2.5s C.5s D.10s
难度: 简单查看答案及解析
-
下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图。根据图所得结论正确的是
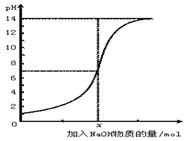
A.原来盐酸的物质的量浓度为1 mol·L-1
B.原来盐酸的物质的量浓度为0.1 mol·L-1
C.x处为含NaOH0.1 mol的溶液
D.x处为含NaOH0.001 mol的溶液
难度: 简单查看答案及解析
-
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH >a,则该电解质可能是
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
难度: 简单查看答案及解析
-
下银锌蓄电池的电极反应为:Zn + 2 OHˉ— 2eˉ= ZnO + H2O,
Ag2O + H2O + 2 eˉ= 2Ag + 2OHˉ。据此判断,氧化银是
A.正极,并被还原 B.负极,并被氧化
C.正极,并被氧化 D.负极,并被还原
难度: 简单查看答案及解析