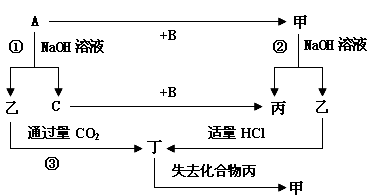
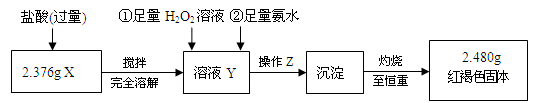
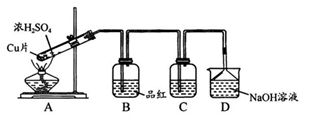
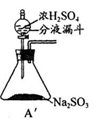
-
下列是某些学生自己总结的一些规律,其中正确的是
A.氧化物不可能是还原产物只可能是氧化产物
B.一种元素可能有多种氧化物,但同一化合价只对应一种氧化物
C.一种物质不是电解质,就一定是非电解质
D.有些化学反应不属于化合、分解、置换、复分解反应中的任何一种反应
难度: 中等查看答案及解析
-
设NA、表示阿佛加德罗常数值,下列说法正确的是
A.1000mL0.1mol·L-1的Al2(SO4)3溶液中,含Al3+ 0.1NA
B.在标准状况下,11.2L氖气中含有NA个氖原子
C.7.8gNa2O2与足量CO2反应,转移电子数为0.1NA
D.62 g Na2O溶于水后所得溶液中含有O2-离子数为NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.臭氧与氧气互为同位素
B.蛋白质属于有机高分子化合物,其水溶液能通过半透膜
C.氨易液化的主要原因是氨分子间易形成氢键
D.水泥、玻璃、玛瑙均属于硅酸盐材料
难度: 中等查看答案及解析
-
将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A. 3mol/LHCl B. 4mol/LHNO3 C. 8mol/LNaOH D. 18mol/LH2SO4
难度: 中等查看答案及解析
-
某合作学习小组讨论辨析以下说法,其中正确的是
①粗盐和酸雨都是混合物;②冰和干冰既是纯净物又是化合物;③沼气和水煤气都是可再生能源;④不锈钢和青铜都是合金;⑤SO2和CO都是酸酐;⑥铁生锈和明矾净水焰色反应中都包含着化学变化;⑦豆浆和雾都是胶体。⑧HF和HI都是强酸
A.①②③④ B.①②④⑦ C.③⑤⑥⑦ D.①②⑤⑥
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.氟气通入水中:2F2+2H2O=4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水: Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C.硫氢化钠溶液与碘反应:HS-+I2=S↓+2I-+H+
D.FeBr2溶液与足量Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
难度: 中等查看答案及解析
-
下图中,锥形瓶内盛有气体x,滴管内盛有液体y,若挤压滴管胶头,使液体y滴入瓶中,振荡,过一会儿可见小气球a鼓气。下列叙述中正确的是
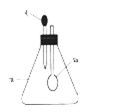
A.x是NH3,y是浓氨水
B.x是S02,y是氢氧化钠浓溶液
C.x是C02,y是稀硫酸
D.x是HCl,y是NaN03稀溶液
难度: 中等查看答案及解析
-
在一种酸性溶液中,存在NO3-、I一、Cl一、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此推断溶液中
A.一定有碘离子,不能确定是否含有氯离子 B.一定含有硝酸根离子
C.一定含有碘离子、氯离子、硝酸根离子 D.不含铁离子和硝酸根离子
难度: 中等查看答案及解析