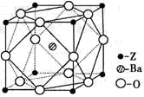
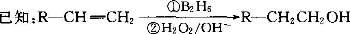-
2013年7月23日,央视记者分别在北京崇文门附近的麦当劳、肯德基以及真功夫3家大型快餐店取回可食用冰块进行抽样检测。检测结果显示:3家快餐店食用冰块菌落总数严重超标。下列说法正确的是
A.肉毒杆菌有毒,可在其中加入硫酸铜使其变性后食用
B.肉毒杆菌在体内水解生成的氨基酸不能成为人体重要的营养物质
C.大肠杆菌分子中不一定含羧基和氨基
D.出血性大肠杆菌和油脂均为能水解的高分子化合物
难度: 中等查看答案及解析
-
短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:① R、Y原子的最外层电子数与电子层数相同;② Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③ W与R同主族。下列说法正确的是
A.元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,属于同种晶体类型
B.元素T、Q、W、Y的原子半径大小为:T<Q<Y<W
C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键
D.由Y和T组成的物质YT是原子晶体,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成
难度: 中等查看答案及解析
-
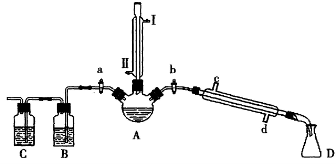
对于实验I〜IV的描述正确的是
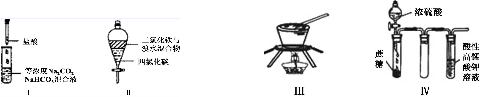
A.实验I :逐滴滴加稀盐酸时,试管中立即产生大量气泡
B.实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是
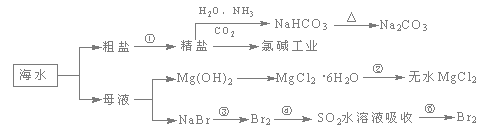
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
难度: 中等查看答案及解析
-
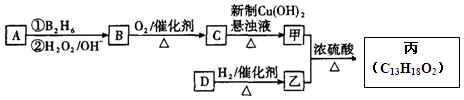
某醇在适当条件下与足量的乙酸发生酯化反应,得到的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,有关该醇应该具有的结构特点的描述正确的是
A.该醇分子中一定具有甲基 B.该醇分子中一定没有甲基
C.该醇分子中至少含有三个碳原子 D.该醇分子中具有两个醇羟基
难度: 中等查看答案及解析
-
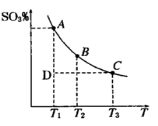
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确的是
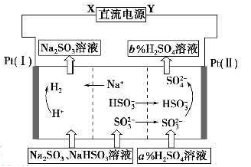
A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
难度: 中等查看答案及解析
-
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:

下列说法正确的是
A.气体A是NO2 B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应 D.X中不能确定的离子是 A13+和C1―
难度: 中等查看答案及解析