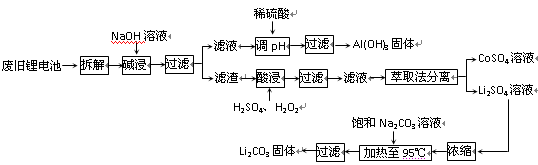
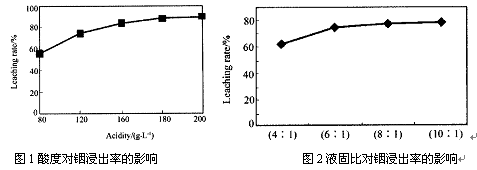
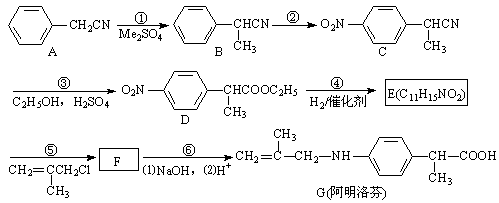
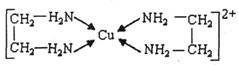
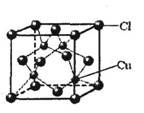
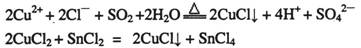-
在下列各组溶液中,离子一定能大量共存的是
A.加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I-
B.常温下,pH=1的溶液:Fe3+、Na+、NO3-、SO42-
C.滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42-
D.含0.1mol/LNH4Al(SO4)2·12H2O的溶液:K+、Ca2+、NO3-、OH-
难度: 简单查看答案及解析
-
2010年4月30日上海世博会举行开园仪式,园区建设采用了许多先进的技术,下列做法不能体现节能减排理念的是
A.发展低碳经济、循环经济,推广使用电动汽车 B.利用太阳能作为能源
C.大量采用绿颜色涂料 D.用再生水灌溉园区绿地
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是
A.H2S的结构式H—S—H B.Mg2+的结构示意图:
C.二氧化碳电子式
D.2-甲基-1-丙醇的结构简式:
难度: 简单查看答案及解析
-
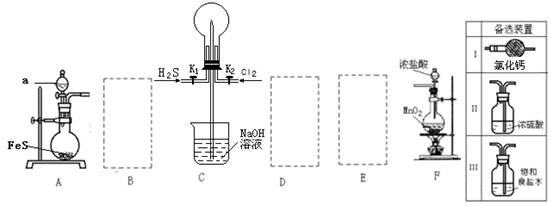
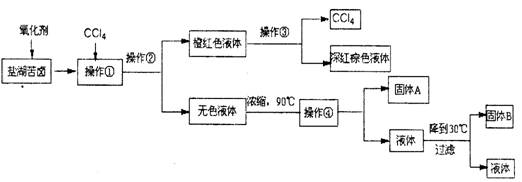
下列实验装置设计正确,且能达到目的的是
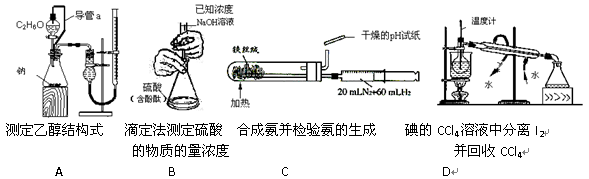
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.3.6g碳与3.36LO2一定条件下恰好完全反应,生成CO分子数一定为0.3 NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA
D.标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA
难度: 简单查看答案及解析
-
下列叙述正确的是
A.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
B.硫酸工业中,接触室中热交换器是利用SO3转化为H2SO4时放出的热量
C.氯碱工业采用离子交换膜法,可防止阳极室产生的Cl2进入阴极室
D.钢铁发生吸氧腐蚀时,阴极的反应式为:Fe-2e→Fe2+
难度: 简单查看答案及解析
-
有A、B、C三种短周期元素,最外层电子数之和为17,质子数之和为31。若C为Ar,则关于A、B两种元素的说法错误的是
A.如果A是金属元素,则B可能是稀有元素
B.如果A的单质通常情况下是气体,则B的单质通常情况下是固体
C.如果A的气态氢化物的水溶液显碱性,则B的气态氢化物的水溶液显酸性
D.如果A的最高正价是+3,则B的单质有两种常见的同素异形体
难度: 简单查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O==Cu2O+H2。下列说法正确的是
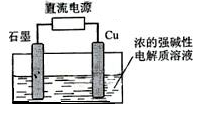
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成
难度: 简单查看答案及解析
-
某药物分子结构简式如下图所示,下列关于该物质的说法不正确的是
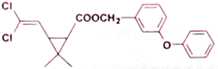
A.分子式为C21H20O3Cl2
B.醚键上的氧原子至少与另外11个原子共面
C.分子中不存在手性碳原子
D.在一定条件下可发生加成、取代、氧化反应
难度: 简单查看答案及解析
-
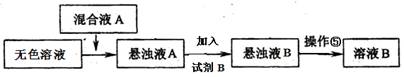
下列离子方程式的书写正确的是
A.弱酸尼泊金酸(
)与碳酸氢钠溶液反应
B.将0.01mol氯气通入10 mL 1 mol / L的FeBr2溶液中 2Fe2++2Br-+3Cl2 = 2Fe3++6Cl-+Br2
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液 Ca2++ HCO3- +OH- = CaCO3↓+H2O
D.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至Ba2+刚好沉淀完全
Ba2++2OH-+H++ SO42- + NH4+ = BaSO4↓+ NH3·H2O +H2O
难度: 简单查看答案及解析
-
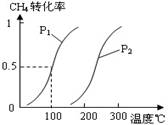
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I3-(aq) △H =Q ,某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
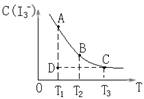
A.反应 I2(aq)+I-(aq)
I3-(aq) △H =Q的 Q>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K2>K1
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
难度: 简单查看答案及解析
-
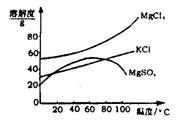
根据表中提供的数据,判断下列说法正确的是

A.等浓度的NaCN、NaHCO3、Na2CO3溶液中,pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b
C.等浓度的NaCN、NaHCO3混合溶液中c(Na+)+ c(H+) =c(CN-) + c(HCO3-) + c(OH-)
D.NaCN溶液中通入少量CO2,发生的反应可表示为:2NaCN + H2O + CO2 = 2HCN + Na2CO3
难度: 简单查看答案及解析