-
化学与生产、生活密切相关。下列叙述中,不正确的是
A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大
B、用活性炭为糖浆脱色和用臭氧漂白纸浆,原理不同
C、钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
D.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下,关于下列说法正确的是

A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
-
下列说法不正确的是
A.外界条件相同时,放热反应的速率一定大于吸热反应的速率
B.化学反应中的能量变化可表现为热量的变化
C.反应物的总能量高于生成物的总能量时,发生放热反应
D.CaO+H2O=Ca(OH)2反应过程中,旧键断裂吸收的能量小于新键形成释放的能量
-
已知H—H键能为436 kJ·mol-1,H—N键能为391 kJ·mol-1,根据化学方程式:
N2+3H2 2NH3 ΔH=-92.4 kJ·mol-1,则N≡N键的键能是
2NH3 ΔH=-92.4 kJ·mol-1,则N≡N键的键能是
A.431 kJ·mol-1 B.946 kJ·mol-1 C.649 kJ·mol-1 D.869 kJ·mo l-1
l-1
-
已知:CH3CH2CH2CH3(g)+13/2O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ/m ol
ol
(CH3)2CHCH3(g)+13/2O2(g)===4CO2(g)+5H2O(l) ΔH=-2 869 kJ/mol
下列说法正确的是
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
-
关于下图所示的原电池,下列说法正确的是
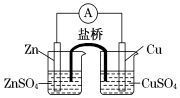
A.电子沿着盐桥从锌电极流向铜电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.电流从锌电极通过电流计流向铜电极
D.铜电极上发生的电极反应是2H++2e-===H2↑
-
下列离子方程式与所述事实相符且正确的是
A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++C1O-+H2O=MnO2↓+C1-+2H+
B.用稀硝酸清洗做过银镜反应的试管:Ag+NO3-+4H+=Ag++NO↑2H2O
C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4C1-
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2C1-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
-
下列对化学反应的认识正确的是
A.化学反应过程中,分子的种类和数目一定发生改变
B.如果某化学反应的△H和△S均小于0,则反应一定能自发进行
C.化学反应过程中,一定有化学键的断裂和形 成
成
D.所有的吸热反应一定要在加热的条件下才能进行
-
下列说法正确的是
A.氯化钠固体不导电,所以氯化钠是非电解质
B.向纯水中加入碳酸钠能使水的电离平衡正向移动,水的离子积增大
C.如图研究的是铁的吸氧腐蚀,实验中红色首先在食盐水滴的中心出现

D.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) 的△H<0 △S<0
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
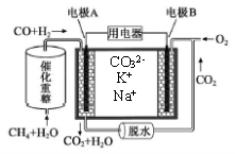
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol e-
3H2+CO,每消耗1molCH4转移12mol e-
B.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
C.电池工作时,CO32-向电极B移动
D.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
-
常温下用石墨作电极,电解100ml 0.1mol/L的硝酸铜和0.1mol/L的硝酸银组成的混合溶液,当阴极上生成的气体体积为0.112L时(标准状况),假设溶液体积不变,下列说法正确的是
A.阳极上产生0.025mol的O2
B.电解过程中总共转移0.2mol的 电子
电子
C.所得溶液中的c(H+)=0.3mol/L
D.阴极增重1.08g
-
下列实验装置能达到实验目的的是

-
如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是
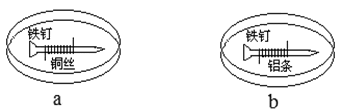
A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
-
用惰性电极分别电解下列各电解质的水溶液,一段时间后(设电解质足量),向电解后溶液中加入适量原电解质,可以使溶液恢复到电解前的浓度的是
A.Cu(NO3)2 B.K2SO4 C.HCl D.NaOH
-
反应A(g)+3B(g)⇌2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应 速率最快的是
速率最快的是
A.v(A)=0.15mol/(L·min) B.v(B)=0.015 mol/(L·s)
C.v(C)=0.40 mol/(L·min) D.v(D)=0.45 mol/(L·min)
-
为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
A.加入NH4HSO4固体,v(H2)不变,生成H2量不变
B.加入少量水,v(H2)减小,生成H2量减少
C.加入CH3COONa固体,v(H2)减小,生成H2量不变
D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少
-
下列说法不正确的是
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
-
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是

A.10 min时,改变的外界条件可能是升高温度
B.0~10 min内,v(H2)=0.15 mol·L-1·min-1
C.恒温下,缩小容器体积,一段时间内v(逆)>v(正)
D.12 min时,反应达平衡的本质原因是气体总质量不再变化
-
己知N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是
2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是
A.在密闭容 器中加入1mol N2和3mol H2充分反应放热92.4kJ
器中加入1mol N2和3mol H2充分反应放热92.4kJ
B.N2(g)+3H2(g) 2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4
2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4
C.增大压强,平衡向右移动,平衡常数增大
D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率为60%
-
在相同的A、B密闭容器中分别充入2 mol SO2和1 mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
A .25% B.大于25% C.小于25% D.无法判断
-
在一密闭容器中,反应aA(g)  bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
-
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600(mol/L) -2
2Z,其平衡常数为1600(mol/L) -2
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
-
一定温度下,可逆反应2NO2(g)  2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥ B.①②③⑤ C.②③④⑥ D.以上全部
-
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是

A.a点 B.b点
C.c点 D.d点
-
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是

A.该反应的△H>0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0-t1min内 CH3OH的平均生成速率为n1/2t1 mol·L-1 min-1
D.A点的反应体系从300℃升高到500℃,达到平衡时n(H2)/n(CH3OH)减小
-
可逆反应:3A(g) 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
A.若C为固体,则B一定是气体 B.B和C一定都是气体
C.B和C可能都是固体 D.B和C不可能都是气体
合物在工农业生产生活中有着重要作用。请回答下列问题:
,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下: Fe2O3(s) + 3CH4(g)
2Fe(s) + 3CO(g) +6H2(g) ΔH>0
CO的产率
池时,负极的电极反应式 。
g)+4H2(g)
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
N2O4;△H<0)