-
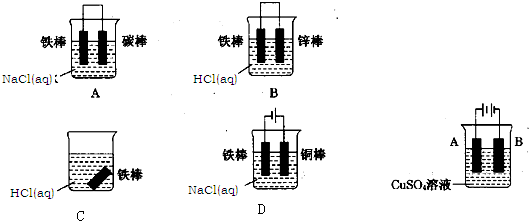
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L-1,c(HI)=4mol•L-1,则此温度下反应①的平衡常数为( )
A.9
B.16
C.20
D.25难度: 中等查看答案及解析
-
下列关于热化学的描述正确的是( )
A.吸热反应一定需要加热
B.化学反应一定有能量变化
C.放热反应的反应速率总是大于吸热反应的反应速率
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下△H不同难度: 中等查看答案及解析
-
用惰性电极实现电解,下列说法正确的是( )
A.电解稀H2SO4溶液,实质是电解水,故溶液pH不变
B.电解稀NaOH溶液,要消耗OH-,故溶液pH减小
C.电解Na2SO4溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解NaCl(aq),在阴极和阳极上析出的气体的产物的物质的量之比为1:1难度: 中等查看答案及解析
-
用惰性电极电解CuSO4和NaCl的混合溶液,开始时阴极和阳极上析出的物质分别是( )
A.H2和Cl2
B.Cu和Cl2
C.H2和O2
D.Cu和O2难度: 中等查看答案及解析
-
下列关于铜电极的叙述正确的是( )
A.在电解池中,铜作阳极,溶液中的阴离子在铜极上失电子
B.用电解法精炼铜时,粗铜作阴极
C.在镀件上电镀铜时,可用金属铜作阳极
D.电解稀H2SO4制H2、O2时,铜作阳极难度: 中等查看答案及解析
-
用惰性电极电解某金属硫酸盐溶液时,在阴极析出a g金属,同时在阳极上放出0.8g气体,如果该金属的相对原子质量为b,则其化合价是( )
A.ab
B.
C.
D.难度: 中等查看答案及解析
-
用石墨棒作电极电解CuCl2溶液时,如果电路中通过的电子数为1.204×1024,则下列叙述正确的是( )
A.阳极上析出金属的质量为64g
B.阳极逸出气体的体积为22.4L(忽略气体的溶解)
C.向溶液中加入135g CuCl2固体可使溶液复原
D.电解一段时间后,溶液中溶质的浓度增大难度: 中等查看答案及解析
-
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( )
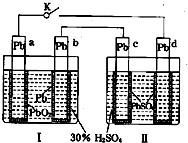
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极难度: 中等查看答案及解析
-
甲醇燃料电池可用于笔记本电脑、汽车等,它一极通入甲醇,电解质是能够传导氢离子的溶液,电池工作时,甲醇被氧化为CO2和H2O,下列叙述不正确的是( )
A.电池总反应为:2CH3OH+3O2=2CO2+4H2O
B.负极的反应为:
C.正极的反应是:
D.电池工作时,H+移向正极难度: 中等查看答案及解析
-
关于如图所示装置的判断,叙述正确的是( )
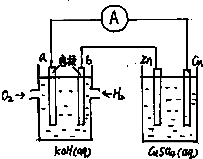
A.左边装置为电解池,右边装置是原电池
B.该装置中铜为正极,锌为负极
C.装置中电子的流向量a→Cu→经过CuSO4溶液→Zn→b
D.当铜片的质量变化为12.8g时,a极上消耗的O2在标况下体积为2.24L难度: 中等查看答案及解析
-
相同材质的铁在下列情形下最不易被腐蚀的是( )
A.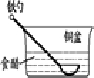
B.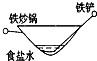
C.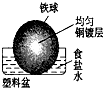
D.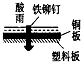
难度: 中等查看答案及解析
-
反应CH3OH(l)+NH3(g)=H2O(g)+CH3NH2(g)在某温度下自发向右进行,若反应的|△H|=17kJ•mol-1,|△H-T△S|=17kJ•mol-1,则下列关系正确的是( )
A.△H>0,△H-T△S<0
B.△H<0,△H-T△S>0
C.△H>0,△H-T△S>0
D.△H<0,△H-T△S<0难度: 中等查看答案及解析
-
在一定温度下的某密闭容器中,当下列物理量不再发生变化时,表明反应:A(s)+2B(g)⇌C(g)+D(g)已达平衡状态的是( )
A.混合气体的密度
B.混合气体的总物质的量
C.混合气体的压强
D.混合气体的总体积难度: 中等查看答案及解析
-
反应NH4HS(s)⇌NH3(g)+H2S(g)在某一温度下达到平衡,下列各种情况中,能使化学平衡发生移动的是( )
A.减少部分NH4HS
B.加入NH4HS固体
C.容积、温度一定,充入氦气
D.温度、容积一定,充入SO2气体难度: 中等查看答案及解析
-
反应SO2(g)+NO2(g)⇌NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量O2,下列说法正确的是( )
A.平衡左移
B.平衡右移
C.平衡不一定移动
D.平衡一会左移,一会右移难度: 中等查看答案及解析
-
对于3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g)反应的化学平衡常数的表达式为( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
在一个容积为2L的密闭容器中,发生如下反应:3A+B⇌2C (A、B、C均为气体),若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/,则10s后容器中的B是( )
A.2.8mol
B.1.6mol
C.3.2mol
D.3.6mol难度: 中等查看答案及解析
-
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
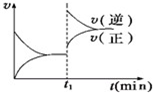
A.2SO2(g)+O2(g)⇌2SO3(g)△H<0
B.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H<0
C.H2(g)+I2(g)⇌2HI(g)△H>0
D.2A(g)+B(g)⇌2C(g)△H>0难度: 中等查看答案及解析
-
合成氨工业中采用了循环操作,主要原因是( )
A.加快反应速率
B.提高NH3的平衡浓度
C.降低NH3的沸点
D.提高N2、H2的利用率难度: 中等查看答案及解析