-
下列过程属于物理变化的是
A. 煤旳干馏 B. 煤旳气化 C. 石油分馏 D. 石油裂化
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法不正确的是
A. 可用料酒除去食物中的腥味
B. 葡萄糖可用于补钙药物的合成
C. 可用乙烯作为水果的催熟剂,使水果尽快成熟
D. 工业生产常用油脂在酸性条件下水解反应来制取肥皂
难度: 中等查看答案及解析
-
从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事。这个先后顺序跟下列有关的是:①地壳中的金属元素的含量②金属活动性③金属的导电性 ④金属冶炼的难易程度 ⑤金属的延展性
A. ①③ B. ②⑤ C. ③⑤ D. ②④
难度: 中等查看答案及解析
-
化学与生活、社会密切相关,下列说法不正确的是
A. 提倡人们购物时不用塑料袋,是为了防止白色污染
B. 塑料、合成橡胶、合成纤维三大合成材料都主要是以硅酸盐为原料生产
C. 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D. 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染
难度: 中等查看答案及解析
-
下列化学用语表达正确的是
A. 乙醇的分子式 C2H5OH B. 苯分子的实验式为CH
C. 次氯酸的电子式 H∶
D. 乙烯的结构简式 CH2CH2
难度: 中等查看答案及解析
-
糖类、油脂、蛋白质都是与生命息息相关的物质,下列有关说法正确的是
A. 葡萄糖和蔗糖是同系物,淀粉和纤维素是同分异构体
B. 淀粉、纤维素、油脂、蛋白质都是高分子化合物,都能发生水解反应
C. 葡萄糖和蔗糖都能与新制Cu(OH)2悬浊液共热,产生砖红色沉淀
D. 天然油脂没有固定的熔点和沸点,所以天然油脂是混合物
难度: 中等查看答案及解析
-
下列除去括号内杂质的有关操作正确的是
A. 苯(硝基苯):加少量蒸馏水震荡,待分层后分液
B. 乙醇(水):加新制生石灰,蒸馏
C. CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D. 乙烷(乙烯):通入氢气发生加成反应
难度: 中等查看答案及解析
-
下列说法不能证明H2(g)+I2(g)
2HI(g)已达平衡状态的是
A. 恒温恒容时,混合气体颜色不再变化
B. 一个H—H 键断裂的同时有两个H—I键断裂
C. 恒温、压强一定,体积可变的容器,混合气体的密度不再变化
D. 恒温恒容时,某一生成物浓度不再变化
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 1 mol苯分子中含有C=C双键数目为3NA
B. 标准状况下,11.2 L CCl4中含有的共价键数目为2NA
C. 1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA
D. 常温常压下,17 g 羟基含有的电子总数为10NA
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 苯和乙烯都能与H2发生加成反应 B. 蔗糖在人体内水解的产物只有葡萄糖 C. 食醋中含有乙酸,乙酸可由乙醇氧化得到 D. 煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是
A. 原子最外层电子数:X>Y>Z B. 单质沸点:X>Z>Y
C. 离子半径:X2->Y+>Z- D. 原子序数:X>Y>Z
难度: 中等查看答案及解析
-
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知通入CH4的一极的电极反应为:CH4+10OH--8e-== CO
+7H2O。下列叙述不正确的是
A. 通入CH4的电极为负极
B. 正极反应为:2O2+4H2O+8e-===8OH-
C. 燃料电池工作时,溶液中的OH-向正极移动
D. 该电池使用一段时间后溶液中KOH的浓度将不变
难度: 困难查看答案及解析
-
某有机物的结构简式如右下图,下列关于该有机物的叙述不正确的是
A. 能与溴单质因发生取代反应而溴的CCl4溶液褪色
B. 能使酸性KMnO4溶液褪色
C. 不能发生加聚反应生成高分子化合物
D. 能发生酯化反应的有两个官能团
难度: 困难查看答案及解析
-
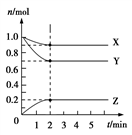
把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:
3A(g) +B(g) ⇋ x C(g) + 2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中错误的是:
A. x=4
B. 达到平衡状态时A的转化率为50%
C. 5s内B的反应速率v(B)=0.05 mol/(L·s)
D. 达到平衡状态时容器内气体的压强与起始时压强比为5: 6
难度: 困难查看答案及解析