-
有些古文或谚语包含了丰富的化学知识,下列解释不正确的是

难度: 中等查看答案及解析
-
下列叙述正确的是
A.BaCO3是难溶于水的强电解质,在医学上用作钡餐
B.常用电解熔融氯化铝和冰晶石的混合物方法冶炼铝
C.明矾净水,硫酸铜溶液作农药,都与金属离子的水解有关
D.锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去
难度: 中等查看答案及解析
-
化学实验操作中必须十分重视安全问题。下列处理方法不正确的是
A.不慎打翻燃着的酒精灯,立即用湿抹布盖灭
B.金属钠着火时,立即用泡沫灭火器进行灭火
C.给盛有液体的试管加热时,要不断移动试管或加入碎瓷片
D.浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液
难度: 中等查看答案及解析
-
乙二酸(HOOC - COOH)与丁醇(C4H10O)存一定条件下反应,生成的二酯有
A.4种 B.6种 C 8种 D.10种
难度: 困难查看答案及解析
-
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件卜,同质量的二种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为2. 24 L,则它们的物质的量一定均为0.1moI
D.同温下,体积相同的两容器分别充2gY气体和lgZ气体,则其压强比为2:1
难度: 困难查看答案及解析
-
一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0
C.将体积增大为原来的2倍,再次达到平衡时,气体的密度变小
D.保持容器体积不变,充入He,平衡向逆反应方向进行
难度: 中等查看答案及解析
-
浓度均为0.1 mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随
的变化关系如图所示。下列叙述正确的是

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH -):a<b
C.相同温度下,电离常数K( HX):a>b
D.
=3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则
减小
难度: 困难查看答案及解析

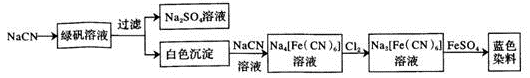
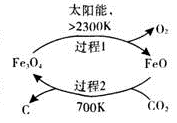

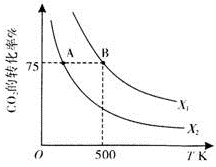
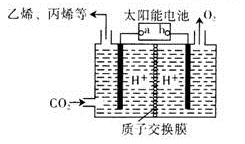
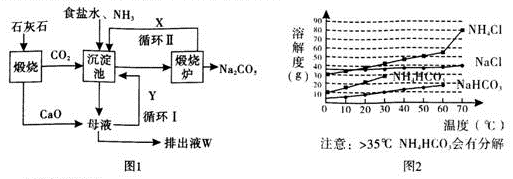
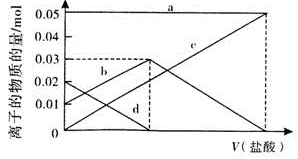
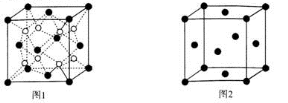
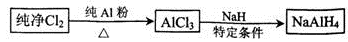
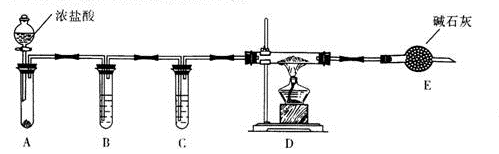
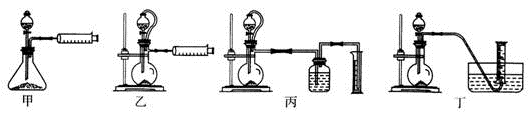


 )的说法正确的是
)的说法正确的是