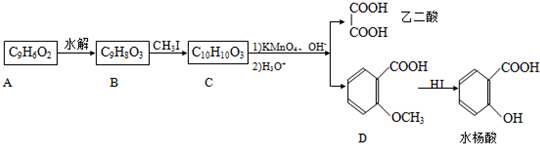
-
某课外小组欲通过实验证明方铅矿分解所得白色粉末中含有氧元素,设计以下的实验装置:
在实验或改进实验中,可能发生的化学反应如下:
PbO+CPb+CO↑,2PbO+C
2Pb+CO2↑,Ca(OH)2+CO2=CaCO3↓+H2O
[Cu(NH3)2]Ac+CO+2NH3⇌[Cu(NH3)4]Ac•CO△H<0.请回答以下问题:
(1)在装置A中不断鼓入氮气的作用是______,能否用空气代替氮气?______,其理由是______.
(2)在实验过程中,未见B装置中有白色沉淀生成,说明在装置A中发生反应的化学方程式是______ Pb+CO↑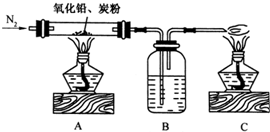
难度: 中等查看答案及解析
-
通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于______.
(2)最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下: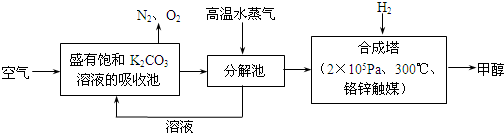
①分解池中反应的化学方程式为______ K2CO3+CO2↑+H2O难度: 中等查看答案及解析
-
绿矾是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)右图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是______.
(2)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制______过量为最佳.序号 反应物用量 产品质量 1 n(H2SO4):n(Fe)>1:1 介于Ⅰ级~Ⅱ级之间 2 n(H2SO4):n(Fe)<1:1 优于Ⅰ级
(3)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀______;乙同学查资料后认为该灰绿色沉淀是由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3的缘故,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路______.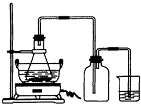
难度: 中等查看答案及解析
-
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).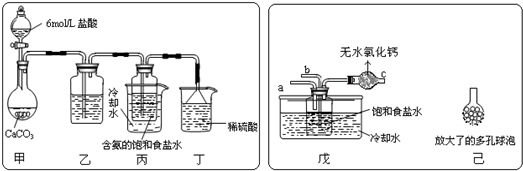
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是______;
(Ⅱ)丁装置中稀硫酸的作用是______;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是______(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从______管通入______ 气体,再从______管中通入______气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:______.难度: 中等查看答案及解析
-
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,下表格是它的说明书.

(1)该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用.
1为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为______( 填试剂的名称 )
②实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应).请配平下列离子方程式
______MnO4-+______Fe2++______H+═______Mn2++______Fe3++______H2O
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液,取出20.00mL,用0.01mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL.该药品可以服用吗?______(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程)______.
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸.含23.6g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和.质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子.写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式)______,琥珀酸亚铁的化学式为______.难度: 中等查看答案及解析
-
七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2 两种盐的溶解度(单位为g/100g水)沉淀物 Al(OH)3 Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 pH值 5.2 3.2 9.7 10.4 11.2
硼镁泥制取七水硫酸镁的工艺流程如下:温度/℃ 10 30 40 50 60 CaSO4 0.19 0.21 0.21 0.20 0.19 MgSO4•7H2O 30.9 35.5 40.8 45.6 / 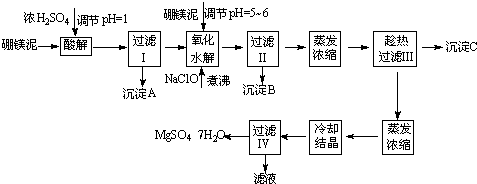
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为______.加热煮沸的主要目的是______.
(2)沉淀B中除MnO2、SiO2外还含有______(填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是______;
(4)沉淀C的化学式是______.过滤Ⅲ需趁热过滤的理由是______.难度: 中等查看答案及解析
-
在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应.请设计实验,证明还原铁粉与水蒸气能够发生反应.
(1)铁粉与水蒸气反应的化学方程式是:______ Fe3O4+4H2↑难度: 中等查看答案及解析
-
[化学-选修物质结构与性质]
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.
单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,电离能(kJ/mol) I1 I2 I3 I4 A 932 1821 15390 21771 B 738 1451 7733 10540
该同学所画的电子排布图违背了______.
(2)根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确______,并阐述理由______.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.写出基态钾原子的电子排布式______,该物质的K原子和C60分子的个数比为______.
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______.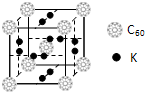
难度: 中等查看答案及解析