-
下列化合物中,既能由单质直接化合制得,又能由复分解反应制得的是( )
A.CuS B.FeS C.Al2S3 D.FeCl2
难度: 中等查看答案及解析
-
PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌.哮喘等疾病的发生密切相关,是灰霾天气的主要原因,它主要来自化石燃料的燃烧(如机动车尾气.燃煤)等,下列与PM2.5相关的说法不正确的是 ( )
A.大力发展电动车,减少燃油汽车的尾气排放量
B.开发利用各种新能源,减少对化石燃料的依赖
C.多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体
D.PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数,下列叙述错误的是( )
A.1mol乙醇中含有C—H键的数目为6 NA
B.46gNO2和N2O4混合气体中含有原子总数为3NA
C.足量Na 与1 mol O2 反应,,转移电子可能为4NA个
D.常温下,1L 0.1 0mol.L-1的
溶液中氮原子数为0.2
难度: 中等查看答案及解析
-
甲.乙.丙.丁四种易溶于水的物质,分别由NH4+.Ba2+.Mg2+.H+.OH-.Cl-.HCO3-.SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
A.甲溶液含有 Ba2+ B.乙溶液含有SO42-
C.丙溶液含有Cl- D.丁溶液含有Mg2+
难度: 困难查看答案及解析
-
下列叙述正确的是( )
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.核外电子总数相同的原子,一定是同种元素的原子
C.金属阳离子被还原后,一定得到该元素的单质
D.能与酸反应的氧化物,一定是碱性氧化物
难度: 中等查看答案及解析
-
三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是( )
A.NF3的氧化性比F2强
B.NF3的还原性比NH3强
C.NF3中的原子最外层均达8电子
D.该反应过程转移了6 mol电子。
难度: 中等查看答案及解析
-
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍 B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸 D.提高溶液的温度
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.盐酸.硝酸和硫酸均有强氧化性和强酸性
B.Fe分别与氯气和稀盐酸反应所得氯化物相同
C. K.Zn分别与不足量的稀硫酸反应所得溶液均呈中性
D制备AlCl3.FeCl3.CuCl2均不能采用将溶液直接蒸干的方法
难度: 中等查看答案及解析
-
下列反应,其产物的颜色按红色.红褐色.淡黄色.蓝色顺序排列的是( )
①金属钠在纯氧中燃烧; ②FeSO4溶液滴入NaOH溶液并在空气中放置一段时间 ;
③FeCl3溶液滴入KSCN溶液; ④无水硫酸铜放入医用酒精中。
A.②③①④ B.③②①④ C.③①②④ D.①②③④
难度: 中等查看答案及解析
-
短周期金属元素甲-戊在元素周期表中的相对位置如表所示,下面判断正确的是( )
甲
丙
乙
丁
戊
A.原子半径: 丙<丁<戊
B.金属性:丙>甲
C.最高价氧化物对应的水化物碱性:乙>丁>戊
D.戊只与强酸反应
难度: 困难查看答案及解析
-
已知W.X.Y.Z为短周期元素,W.Z同主族,X.Y.Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X.Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.W与X形成的化合物中只含离子键
B.X、Y、Z、W的原子半径依次减小
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
难度: 困难查看答案及解析
-
下列有关实验原理.方法和结论都正确的是( )
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡.静置后分液,可除去苯中少量苯酚
D.已知I3-
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项 实验操作 实验现象 结 论
A 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 均有固体析出 蛋白质均发生变性
B 将少量某无色气体通入澄清石灰水 出现白色沉淀 该气体一定是CO2
C 分别用测定常温下0.1 mol·L--1 Na2SiO3和Na2CO3的PH PH: Na2SiO3﹥Na2CO3 非金属性Si﹥C
D 向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中,
滴加少量AgNO3溶液 出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
难度: 中等查看答案及解析
-
在化学学习与研究中类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是( )
①HCl气体可被浓硫酸干燥,HI气体也可被浓硫酸干燥,
②过量CO2通入漂白粉溶液,所得溶液具有漂白性,过量SO2通入漂白粉溶液,所得溶液也具有漂白性(不考虑溶解)
③苯不能使酸性高锰酸钾褪色,甲苯也不能使酸性高锰酸钾褪色
④Al(OH)3.Cu(OH)2受热易分解,Fe(OH)3受热也易分解
⑤37℃时,Fe3+.Cu2+能催化H2O2的分解;100℃时,MnO2.过氧化氢酶也能催化H2O2的分解
A.④ B.②③ C.④⑤ D.①②④⑤
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A.Na2CO3溶液: C(OH—)+ C(H+)= C(HCO3—)+2 C(H2CO3)
B.0.1
溶液:
C.室温下,向0.01
溶液中滴加
溶液至中性:
D.25℃时,
.浓度均为0.1
的
混合溶液:
难度: 困难查看答案及解析
-
用石墨作电极电解AgNO3溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
A.AgNO3 B.H2O C.Ag2O D.Ag(NH3)2OH
难度: 中等查看答案及解析
-
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备
HCOOH的原理示意图,下列说法不正确的是( )
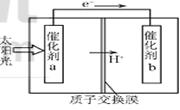
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH
难度: 中等查看答案及解析
-
下列说法正确的是:( )
A.在100 ℃.101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)
H2O(l) 的ΔH =+ 40.69 kJ·mol-1
B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-)= 6.82 × 10-6
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
D.已知:
共价键
C-C
C=C
C-H
H-H
键能/ kJ·mol-1
348
610
413
436
则可以计算出反应
的ΔH为-384 kJ·mol-1
难度: 困难查看答案及解析