-
在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
难度: 简单查看答案及解析
-
下列两组热化学方程式中,有关ΔH的比较正确的是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2
②NaOH(aq)+H2SO4(浓)===Na2SO4(aq)+H2O(l) ΔH3
NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH4
A. ΔH1>ΔH2;ΔH3>ΔH4 B. ΔH1>ΔH2;ΔH3<ΔH4
C. ΔH1=ΔH2;ΔH3<ΔH4 D. ΔH1<ΔH2;ΔH3<ΔH4
难度: 中等查看答案及解析
-
关于A(g)+2B(g)===3C(g)的化学反应,下列表示的反应速率最大的是( )
A. v(A)=0.7 mol/(L·min) B. v(B)=1.2mol/(L·min)
C. v(C)=1.2 mol/(L·min) D. v(B)=0.01 mol/(L·s)
难度: 简单查看答案及解析
-
下列反应中可判断为可逆反应的是( )
A.氢气和氯气点燃生成氯化氢,氯化氢受热分解为氢气和氯气
B.氮气和氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气
C.单质溴可以置换出碘,氯气又可以置换出溴
D.氯气和水反应生成盐酸和次氯酸,次氯酸光照条件下可分解为盐酸和氧气
难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g),能增大正反应速率的措施是( )
A. 通入大量O2 B. 增大容器容积
C. 移去部分SO3 D. 降低体系温度
难度: 中等查看答案及解析
-
一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g)
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
难度: 中等查看答案及解析
-
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 。 下列叙述错误的是
A. 使用Cu-Zn-Fe催化剂可大大提高生产效率
B. 反应需在300℃条件下进行可推测该反应是吸热反应
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
难度: 困难查看答案及解析
-
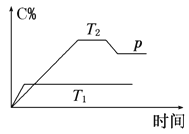
已知:4NH3 (g)+5O2 (g)
4NO (g)+6H2O (g) ΔH=-1 025kJ/mol,该反应是一个可逆反应,若反应起始物质的量相同,下列关于该反应的示意图不正确的是( )
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g)
CO(g)+H2O(g),K为此反应化学平衡常数,其中K和温度的关系如下表:
t/℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
根据以上信息推断以下说法正确的是( )
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 温度升高H2的体积分数减小
D. 该反应的化学平衡常数越大,反应物的转化率越低
难度: 简单查看答案及解析
-
对于化学反应能否自发进行,下列说法中不正确的是 ( )
A. 若ΔH<0,△S>0,任何温度下都能自发进行
B. 若ΔH>0,△S<0,任何温度下都不能自发进行
C. 若ΔH>0,△S>0,低温时可自发进行
D. 若ΔH<0,△S<0,低温时可自发进行
难度: 中等查看答案及解析
-
下列物质在水溶液中的电离方程式书写正确的是( )
A. CH3COOH
H++CH3COO-
B. NaHSO4===Na++HSO
C. H3PO4
3H++PO
D. NaHCO3
Na++H++CO
难度: 中等查看答案及解析
-
室温下向10 mL 0.1 mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中导电离子的数目减小
B. 溶液中
 不变
不变C. 醋酸的电离程度增大,c(H+)亦增大
D. 醋酸的电离常数K随醋酸浓度减小而减小
难度: 简单查看答案及解析
-
在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10mol/L。下列有关该溶液的叙述正确的是( )
A. 该溶液一定呈酸性
B. 该溶液中的c(H+)可能等于10-5
C. 该溶液的pH可能为4,可能为10
D. 该溶液有可能呈中性
难度: 中等查看答案及解析
-
常温时,下列叙述正确的是( )
A. 稀释pH=3的醋酸溶液,溶液中所有离子的浓度均降低
B. 相同条件下,pH与体积均相同的盐酸和醋酸溶液与足量的Mg反应,盐酸生成的H2的体积多于醋酸。
C. pH均为11的NaOH和NH3·H2O溶液中,水的电离程度不相同
D. 用相同浓度的氢氧化钠溶液中和pH与体积均相同的硫酸和醋酸溶液,醋酸溶液消耗氢氧化钠的物体积多于硫酸。
难度: 中等查看答案及解析