-
下列说法中,正确的是
A.化学的特征就是认识分子和制造分子
B.在任何条件下,1mol任何气体的体积都约是22.4L
C.在化学反应中,参加反应的各物质的质量比等于其物质的量之比
D.俄国化学家门捷列夫提出原子学说,为近代化学的发展奠定了坚实的基础
难度: 简单查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“Na2CO3”的分类不正确的是
A.电解质 B.碳酸盐 C.钠盐 D.碱
难度: 简单查看答案及解析
-
用特殊的方法把固体物质加工到纳米级的超细粉末粒子,然后制得纳米材料。下列分散系中分散质的微粒直径和这种粒子具有相同数量级的是
A.溶液 B.悬浊液 C.胶体 D.乳浊液
难度: 简单查看答案及解析
-
下列溶液中,Na+ 物质的量浓度最大的是
A.1mL 0.5mol·L-1的NaNO3溶液 B.100mL 0.01 mol·L-1的NaCl溶液
C.10mL 0.1mol·L-1的NaOH溶液 D.100mL 0.1mol·L-1的Na2SO4溶液
难度: 简单查看答案及解析
-
钠与水反应时的现象与钠的下列性质无关的是
A.钠的熔点低 B.钠的硬度小 C.钠的密度小 D.有强还原性
难度: 简单查看答案及解析
-
关于次氯酸性质的描述,错误的是
A.不稳定,易分解放出氧气 B.能使潮湿的有色布条褪色
C.是一种很强的氧化剂 D.是一种比碳酸酸性强的酸
难度: 简单查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是
A.H+ Na+ CO32- Cl- B.Ba2+ Na+ Cl- SO42-
C.Ag+ Al3+ NO3- H+ D.K+ H+ SO42- OH-
难度: 简单查看答案及解析
-
下列物质属于非电解质的是
A.NH3 B.(NH4)2SO4 C.Cl2 D.CH3COOH
难度: 简单查看答案及解析
-
在标准状况时,m克某气体X的体积为V升,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,则下列有关该气体的说法不正确的是
A.M/NA表示该气体单个分子的质量 B.VM/m表示该气体的物质的量浓度
C.M/22.4表示标准状况下该气体的密度 D.mNA/M表示该气体的分子数
难度: 简单查看答案及解析
-
.如果NO3-、Fe2+、SO42-、M四种离子以物质的量之比4∶2∶1∶2共存于同一溶液中,那么,M可能是
A.Cl— B.H+ C.Na+ D.Mg2+
难度: 简单查看答案及解析
-
根据下列反应判断氧化剂的氧化性由强到弱的顺序,正确的是
① Cl2+2KI ══ I2+2KCl ② 2FeCl3+2HI ══ I2+2FeCl2+2HCl
③ 2FeCl2+Cl2 ══ 2FeCl3 ④ I2+SO2+2H2O ══ 2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Cl2>Fe3+>I2>SO2
C.Fe3+>Cl2>I2>SO2 D.Cl2>Fe3+>SO2>I2
难度: 简单查看答案及解析
-
2004年4月16日,重庆天原化工总厂发生了氯气泄漏及爆炸特大事故,喷出的氯气造成了多人伤亡。作为现场的消防干警下列处理方法和过程较合理的是:
①及时转移疏散人群,同时向有关部门如实报告事故的有关情况;②被转移人群应戴上用浓NaOH溶液处理过的口罩(湿润);③用高压水枪向空中喷洒含碱性物质的水溶液解毒;④被转移人群可戴上用Na2CO3处理过的口罩(湿润);⑤将人群转移到地势较低的地方;⑥及时清理现场,检查水源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
A.②③④⑤ B.①③④⑥ C.①②⑤⑥ D.①③⑤⑦
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A.H2SO4的摩尔质量是98
B.等物质的量的O2和O3中所含的氧原子数相同
C.将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol·L-1
D.等质量的CO与CO2中所含碳原子数之比为11︰7
难度: 简单查看答案及解析
-
下列离子方程式的书写,正确的是
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B.氢氧化钡溶液与盐酸反应:OH-+H+ = H2O
C.三氯化铁溶液中加入铁粉: Fe3++ Fe= 2Fe2+
D.钠投入水中:Na +H2O = Na+ + OH- + H2↑
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
难度: 简单查看答案及解析
-
有体积相同的两份营养液,其配方如下:
KCl
K2SO4
ZnSO4
ZnCl2
第一份
0.3mol
0.2mol
0.1mol
—
第二份
0.1mol
0.3mol
—
0.1mol
试判断两份营养液中各离子浓度的关系是
A.仅c(K+)相同 B.仅c(Cl-)相同 C.完全相同 D.完全不同
难度: 简单查看答案及解析
-
某溶液中含有Ba2+、Cu2+ 和Ag+,现用氢氧化钠、盐酸和硫酸钠溶液将三种离子逐一沉淀分离。其流程如下图所示:(其中“溶液2”为无色溶液)
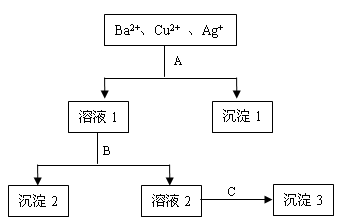
回答下列问题:
(1)沉淀1的化学式:________。
(2)写出下列反应的离子方程式:
溶液1 + B:。
溶液2 + C:________ 。
难度: 简单查看答案及解析