-
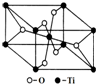
北京2008奥运会金牌直径为70mm,厚6mm.某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成.为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误( )
A.硫酸铜溶液
B.盐酸
C.稀硝酸
D.硝酸银溶液难度: 中等查看答案及解析
-
下列关于有机物的说法中,不正确的是( )
A.液化石油气和天然气的主要成分都是甲烷
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.用新制的Cu(OH)2可检验尿液中的葡萄糖难度: 中等查看答案及解析
-
海水是一个巨大的化学资源库,下列有关海水综合利用的说法不正确的是( )
A.在苦卤中加石灰乳过滤得沉淀,然后加盐酸,经浓缩、结晶、脱水、电解可以得到金属镁
B.从海水中可得到NaCl,电解熔融NaCl或其水溶液都可制得Cl2
C.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向
D.将苦卤浓缩、氧化,鼓入热空气或水蒸气可提取溴难度: 中等查看答案及解析
-
化学与环境、工农业生产等密切相关,下列叙述正确的是( )
A.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关
B.将草木灰和硫酸铵混合施用,肥效更高
C.棉花、蚕丝和锦纶的主要成分都是纤维素
D.为了防止中秋月饼等富脂食品氧化变质,延长保质期,可在包装袋中放入生石灰难度: 中等查看答案及解析
-
化学概念在逻辑上存在如下关系:
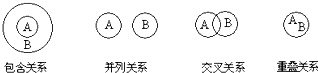
对下列概念的说法正确的是( )
A.化合物与电解质属于重叠关系
B.化合物与碱性氧化物属于交叉关系
C.溶液与胶体属于并列关系
D.氧化还原反应与放热反应属于包含关系难度: 中等查看答案及解析
-
不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在科学研究中获得了广泛的应用.如2H、13C、15N、18O、34S等常用作环境分析指示物.下列有关说法正确的是( )
A.34S原子核内中子数为16
B.16O与18O互称同位素
C.13C和15N原子核内的质子数相差2
D.2H+结合OH-的能力比1H+更强难度: 中等查看答案及解析
-
用下列装置进行的实验,不能达到相应实验目的是( )
A.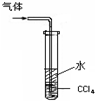
吸收尾气HCl
B.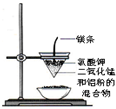
制取金属锰
C.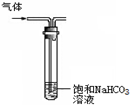
洗气除去CO2中的SO2
D.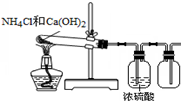
实验室制取NH3难度: 中等查看答案及解析
-
下列溶液中,各组离子一定能够大量共存的是( )
A.无色溶液中:K+、H+、SO42-、MnO4-
B.=10-10的溶液中:K+、Na+、CO32-、AlO2-
C.能使pH试纸变红的溶液中:Ca2+、Na+、CO32-、SO42-
D.含有大量Fe3+的溶液中:H+、Mg2+、I-、SCN-难度: 中等查看答案及解析
-
氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C
2AlN+3CO合成.下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41g难度: 中等查看答案及解析
-
在给定条件下,下列加点的物质在化学反应中完全消耗的是( )
A.用50mL 8mol/L的浓盐酸与10g二氧化锰共热制取氯气
B.向100mL 3mol/L的硝酸中加入5.6g铁
C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
D.在50MPa 500℃和铁触媒催化的条件下,用1.2mol氮气和3mol氢气合成氨难度: 中等查看答案及解析
-
X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是( )
X Y Z W A C CO CO2 O2 B Na Na2O Na2O2 O2 C AlCl3 Al(OH)3 NaAl(OH)4 NaOH D Fe FeCl2 FeCl3 Cl2
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在一定条件下,对于反应mA(g)+nB(g)⇌cC(g)+dD(g),C物质的含量(c%)与温度、压强的关系如图所示,下列判断正确的是( )
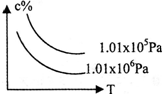
A.△H<0;m+n<c+d
B.△H>0;m+n>c+d
C.△H>0;m+n<c+d
D.△H<0;m+n>c+d难度: 中等查看答案及解析
-
(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液.电池总反应为:N2H4+O2=N2+2H2O.下列关于该燃料电池工作时的说法正确的是( )
A.负极的电极反应式是:N2H4+4OH-→4H2O+N2↑+4e-
B.正极的电极反应式是:O2+4H++4e-→2H2O
C.溶液中阴离子向正极移动
D.电解后电解质溶液的碱性增强难度: 中等查看答案及解析
-
用CH4催化还原 NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
A.若用标准状况下 4.48LCH4 还原 NO2生成N2和水蒸气,放出的热量为 173.4kJ
B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1
C.反应 ①②转移的电子数相同
D.反应 ②中当4.48LCH4 反应完全时转移的电子总数为1.60 mol难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.0.1mol•L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c (OH-)
B.0.1mol•L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.0.1mol•L-1的NH4Cl溶液与0.05mol•L-1的NaOH溶液等体积混合:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)难度: 中等查看答案及解析
-
已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol•L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol•L-1.若在5mL含有KCl和KI各为0.01mol•L-1的溶液中,加入8mL001mol•L-1AgNO3溶液,下列叙述正确是( )
A.混合溶液中c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-)
B.混合溶液中c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-)
C.加入AgNO3溶液时首先生成AgCl沉淀
D.混合溶液中约为1.02×103
难度: 中等查看答案及解析