-
2014年的南京青奥会将秉持“绿色青奥”这一理念,下列行为不符合这一主题的是
A.推广使用一次性木筷,减少疾病传染
B.推广使用电动汽车、天然气汽车等环保公共交通工具
C.大力发展太阳能和风力发电机可缓解电力紧张问题
D.将地沟油回收加工为燃料油,提高资源的利用率
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.四氯化碳分子球棍模型:
B.二氧化硅的分子式:SiO2
C. S2-离子结构示意图
D.聚丙烯的结构简式:

难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离出的c(H+)·c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32-
B.澄清透明溶液:Mg2+、Cu2+、Cl-、SO42-
C.使酚酞变红色的溶液:NH4+、K+、AlO2-、NO3-
D.含0.1mol·L-1 KI的溶液:Fe3+、Na+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列有关物质性质的应用正确的是
A.石英坩埚耐高温,可用来加热熔化NaOH固体
B.浓硫酸有脱水性,可用作干燥剂
C.二氧化硫有漂白性,可大量用于加工食品使食品漂白
D.医用酒精能使蛋白质变性,可用来消毒杀菌
难度: 简单查看答案及解析
-
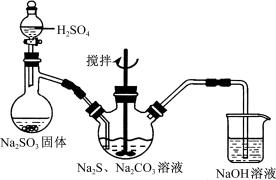
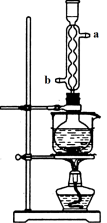
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
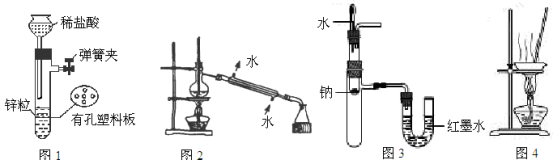
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
C.用图3所示装置验证Na和水反应的热效应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
难度: 简单查看答案及解析
-
下图为A、B两种物质间的转化关系(其中C、D是反应物,部分产物已省略)。
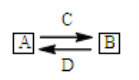
以下判断不正确的是
A.若A是AlCl3,则C既可以是强碱,也可以是弱碱
B.若A是碱性气体,则A和C可能发生氧化还原反应,也可能发生非氧化还原反应
C.上述变化过程中,A可以是酸、碱、盐,也可以是单质或氧化物
D.若A→B是氧化还原反应,则C、D在上述转化过程中一定有一种为氧化剂,另一种为还原剂
难度: 中等查看答案及解析
-
设NA 为阿伏加德罗常数的值。下列说法正确的是
A.0.1molN2与足量的H2反应,转移的电子数是0.6NA
B.常温下, 0.1 mol·L-1 NH4NO3溶液中含有的氮原子数是0.2NA
C.常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA
D.2.24 L CO和CO2的混合气体中所含的碳原子数为0.1 N A
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O
B.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH- = CaCO3↓+CO32-+2H2O
C.向Ca(ClO)2 溶液中通入过量的 SO2:C1O- + SO2 + H2O = HClO + HSO3-
D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2 = 2Fe3++2OH-
难度: 中等查看答案及解析
-
电化学降解法治理水中硝酸盐的污染原理如图所示。
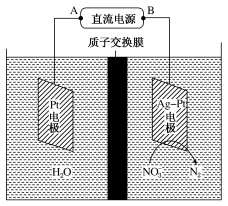
下列说法正确的是
A.B为电源正极
B.电解过程中H+ 向阳极移动
C.阴极反应式为2NO
+6H2O+10e-= N2↑+12OH-
D.理论上电解过程中阴、阳两极产生的气体在同温同压下体积比为2︰5
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.元素Y的最高正化合价为+6
B.离子半径的大小顺序为W>Q>Z>X>Y
C.简单氢化物的沸点Y>W
D.元素W的最高价氧化物对应的水化物酸性比Q的强
难度: 中等查看答案及解析
-
下列说法正确的是
A.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B.能自发进行的化学反应,一定是△H<0、△S>0
C.将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠
D.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
难度: 中等查看答案及解析
-
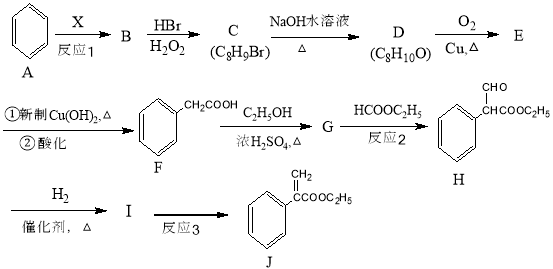
胡妥油(D)用作香料的原料,它可由A合成得到:
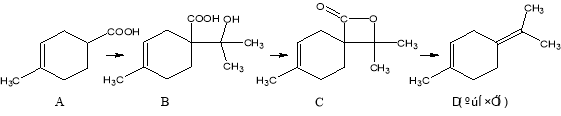
下列说法正确的是
A.若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应
B.有机物D分子中所有碳原子一定共面
C.有机物C 的所有同分异构体中不可有芳香族化合物存在
D.有机物B 既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体
难度: 中等查看答案及解析
-
下列说法正确的是
选项
实验
解释或结论
A
用洁净的Pt丝蘸取某溶液进行焰色反应,火焰呈黄色
该溶液中一定含有Na+,
无K+
B
用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧
CO2、H2O与Na2O2反应是放热反应
C
向溴水中滴入植物油,振荡后,油层显无色
溴不溶于油脂
D
将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色
H2O2的氧化性比Fe3+强
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数
(25℃)
Ka=1.77×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
下列选项正确的是
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
难度: 中等查看答案及解析
-
某恒温密闭容器中,可逆反应A(s)
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C. 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ
D. 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
难度: 中等查看答案及解析