-
热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______(用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)  H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min |
| H2O | CO | H2 | CO | |
| 1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| | | | | | | |
①该反应的逆反应为______(填“吸热”或“放热”)反应;实验2的平衡常数K=________。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______(填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
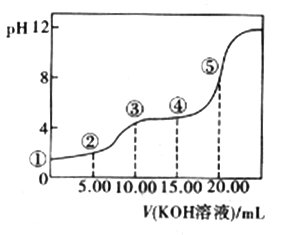
a.点②所示溶液中的电荷守恒式为________________________。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________mol/L。
-
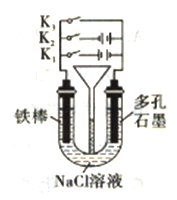
工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。

(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。

(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。
-
2015年10月,我国著名药学家屠呦呦因发现治疗疟疾新型药物青蒿素和双氢靑蒿素而获得2015年诺贝尔生理学或医学奖,成为首位获得诺贝尔科学奖的华人女科学家,震惊世界,感动中国。青蒿素(C15H22O5)的结构如图甲所示。请回答下列问题:
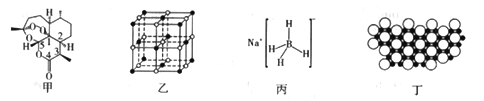
(1)组成靑蒿素的三种元素电负性由大到小的顺序是_________;在基态O原子中,核外存在________对自旋方向相反的电子。
(2)下列关于青蒿素的说法正确的是_______(填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其他原子成键
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备方法为4NaH+ B(OCH3)3 NaBH4+3CH3ONa。
NaBH4+3CH3ONa。
①NaH为______晶体,图乙是NaH晶胞结构,则NaH晶体的配位数是______;若晶胞棱长为a,则Na原子间最小核间距为_______。
②B(OCH3)3中B采用的杂化类型是__________。写出一种与B(OCH3)3具有相同空间构型的分子或离子:______________________。
③NaBH4结构如图丙所示,结构中存在的作用力有__________。NaBH4是有机化学中的一种常用还原剂,其在热水中水解生成偏硼酸钠和氢气,该反应的化学方程式为______________。
(4)硼(B)及其化合物在化学中有重要的地位。科学家发现硼化镁在39k时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图丁是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同—平面上。根据图示确定硼化镁的化学式为_______________。
-
2015年10月,中国科学家坩呦呦获得了2015年度诺贝尔生理学或医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特別是发展中国家的数百万人的生命”。已知青蒿素的一种化学合成方法的部分工艺流程如图24:
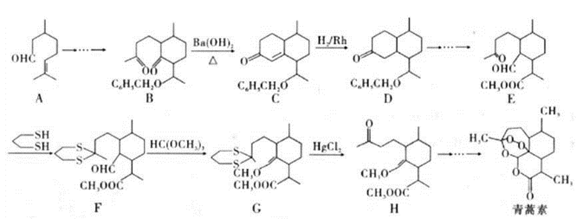
已知:①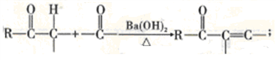
②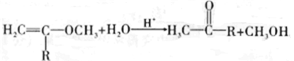
请冋答下列问题:
(1)下列有关说法正确的是_______(填序号)。
A.青蒿素属于环状化合物,但不属于芳香族化合物
B.青蒿素易溶于水,难溶于乙醇、苯等
C.一定条件下,青蒿素能与氢氧化钠溶液反应
D.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
(2)化合物A中含有的非含氧官能团的名称是_______,请选择下列合适的试剂来检验该官能团,试剂加入的正确顺序为____。
A.溴水 B.稀盐酸
C.新制氢氧化铜悬浊液 D.氢氧化钠溶液
(3)该工艺流程中设计E→F、G→H的目的是_________________。
(4)H与稀硫酸共热时反应的化学方程式为_____________________。
(5)M与A互为同系物,但比A少两个碳原子。满足下列条件的M的同分异构体有______种(不考虑立体异构)。
①含有六元环 ②能发生银镜反应
(6)请结合所学知识和上述信息,写出以笨甲醛和氯乙烷为原料,制备苄基乙醛( CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下:
CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下: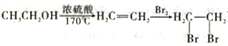 )
)
的名称为2-丁醇
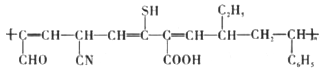 使用的单体有3种
使用的单体有3种






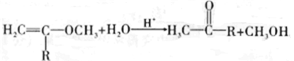
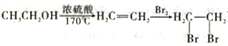 )
)