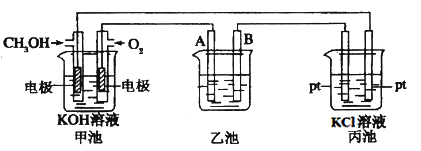
-
元素X和元素Y位于第二周期,其中X的原子最外层中具有最多的未成对电子,Y的原子只有两种形状的电子云,且两种形状的电子云的电子数相等,则由x、y组成的微粒中,不可能存在的是
A. X2Y5 B. XY42- C. XY2- D. XY3-
难度: 中等查看答案及解析
-
下列现象中不能用电子跃迁原理解释的是

难度: 简单查看答案及解析
-
下列对化学反应的认识错误的是
A.必然引起物质状态的变化 B.会产生新的物质
C.会引起化学键的变化 D.必然伴随着能量的变化
难度: 简单查看答案及解析
-
下列微粒中,含有孤对电子的是
A.SiH4 B.H2O C.CH4 D.NH4+
难度: 简单查看答案及解析
-
下列各表示式中轨道数最多的是
A. 7s B. 6p C. 5d D. 4f
难度: 简单查看答案及解析
-
若一个原子在第三电子层上有10个电子,则该层的电子排布式可以写成
A. 3s10 B. 3d10 C. 3s23p63d2 D. 3s23p64s2
难度: 简单查看答案及解析
-
下列各微粒中,能使水的电离平衡向电离方向移动,且使溶液的pH>7的是
A.
B.OH- C.Fe3+ D.HCO3-
难度: 简单查看答案及解析
-
将下列溶液分别蒸干并灼烧,能得到该溶液的溶质的是
A.Na2CO3溶液 B.A1(NO3)3溶液 C.FeCl3溶液 D.NH4C1溶液
难度: 中等查看答案及解析
-
0.01 mol•L-1HA溶液的pH=4,则该溶液中有关浓度的关系式正确的是
A.c(H+)>c(HA) B.c(OH-)>c(HA) C.c(HA)>c(A-) D.c(H+)<c(A-)
难度: 中等查看答案及解析
-
下列物质的电离方程式书写正确的是
A.NaHS==Na++H++S2- B.H2SO3
2H++SO32-
C.HClO==H++ClO- D.Fe(OH)3
Fe3++3OH-
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.使酚酞变红色的溶液中:Na+、A13+、SO42-、Cl-
B.
=10的溶液中:NH4+、Ca2+、 Cl-、NO3-
C.在氯水中:Fe2+、K+、NO3-、SO42-
D.水电离出的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、AlO2-、HCO3-
难度: 困难查看答案及解析
-
下列说法正确的是
A.原电池的正极材料必须是金属
B.原电池的负极发生还原反应
C.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
D.原电池可以把物质内部的能量全部转化为电能
难度: 简单查看答案及解析
-
电解H2SO4和NaCl的混合溶液,起始一段时间阴极和阳极上分別析出的物质是
A.H2、O2 B.Cu、O2 C.H2、Cl2 D.Cu、Cl2
难度: 中等查看答案及解析
-
下列有关元素周期表及元素周期律的说法错误的是
A. N能层的能级数最多为3个
B. Cu元素在元素周期表的ds区
C. F元素在同周期中电负性最大
D. 根据对角线规则,铍和铝的化学性质具有相似性
难度: 简单查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ•mol-1。根据下表所列数据判断错误的是
电离能
元素I1
I2
I3
I4
X
496
4562
6912
9543
Y
578
1817
2745
11600
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氧形成化合物时,化学式可能是X2O2
D.若元素Y处于第三周期,则它可与冷水剧烈反应
难度: 中等查看答案及解析
-
己知元素X、Y同周期,且电负性X>Y,下列说法中一定不正确的是
A. 第一电离能:Y<X
B. 最简单气态氢化物的稳定性: HmY> HnX
C. 最高价含氧酸的酸性:元素X对应酸的酸性强于Y
D. X和Y形成的化合物中,X显负价,Y显正价
难度: 中等查看答案及解析
-
铜—锌电池工作原理如图所示,下列说法正确的是

A.电子从锌电极通过电流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极上有红色固体析出
D.铜电极上发生的电极反应是2H++2e-=H2↑
难度: 中等查看答案及解析
-
有关水解原理的应用,下列说法正确的是
A.将NaHCO3溶液蒸干并灼烧时,HCO3-+H2O
H2CO3+OH-向正向移动,最后可以得到NaOH固体
B.MgSO4酸性溶液中含有杂质离子Fe2+时,可以先加人氯水将Fe2+氧化成Fe3+,再加入MgO除去杂质
C.为抑制离子的水解,在配制SnCl2溶液时,可以加入适量稀硫酸加以酸化
D.用MgCl2 • 6H2O制取无水MgCl2时,需要在HCl气流中加热
难度: 困难查看答案及解析
-
工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是
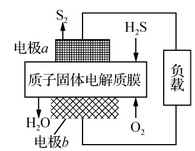
A.电极a为电池的负极
B.电极b上的电极反应式为:O2+4H++4e-=2H2O
C.若电路中通过2 mol电子,则电池内部释放632 kJ热能
D.若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
难度: 极难查看答案及解析
-
Li- SOCl2电池是迄今具有最高能量比的电池。该电池中锂为负极,碳棒为正极,无水四氯铝酸锂(LiAlCl4)的SOCl2溶液为电解液。电池总反应为4Li+2 SOCl2=4LiCl+SO2+S。下列说法不正确的是
A.负极的电极反应式为Li-e-=Li+
B.正极的电极反应式为2SOCl2+4e-=SO2+S+4Cl-
C.若电解液中含有水,则该电池的效率将大大降低
D.若负极有14gLi参加反应,则理论上.流过电路中的电子数约为1.204×1023
难度: 困难查看答案及解析
-
室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
加入的物质
结论
A
50mL1 mol·L-1硫酸
反应结束后,c(Na+)=c(SO42-)
B
0.05molNa2O2
溶液中
增大
C
50mL H2O
由水电离出的c(H+)·c(OH-)不变
D
0.1molNaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
难度: 困难查看答案及解析
-
最近科学家发明了一种酶电池,该电池的电解质溶液中含有酶,酶分解纤维素挥产生氢离子,,氢离子与空气混合产生水,从而形成电流。其结构如图所示。下列关于该电池的叙述不正确的是

A.该电池属于燃料电池 B.a为该电池的正极
C.工作一段时间后,溶液的pH增大 D.H+向a极移动
难度: 困难查看答案及解析
-
常温下,下列溶液中有关物质的量浓度关系不正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(M+) >c(H+) > c(OH-) >c(A-)
B.pH相等的NaOH和Na2CO3两种溶液:c(NaOH) <c(Na2CO3)
C.等体积等物质的量浓度CH3COOH溶液和CH3COONa溶液混合:c(CH3COO-) + c(CH3COOH)=2c(Na+)
D.0.1mol·L-1 pH=4的NaHA溶液:c(HA-)>c(H+)>c(A2-)
难度: 困难查看答案及解析
-
25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是
A.饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)更大
B.在Mg(OH)2的悬浊液中加入少量NH4Cl固体,c(Mg2+)增大
C.Mg(OH)2固体在0.01 mol·L-1的氨水中的Ksp比在0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.在Mg(OH)2的悬浊液加入浓NaF溶液,Mg(OH)2不可能转化成为MgF2
难度: 中等查看答案及解析
-
用0.1 mol•L-1的NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol•L-1的HC1溶液和HX溶液,溶液的pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是

A.M点对应溶液中:c(HX)<c(X-)
B.HX的电离平衡常数Ka约为1×10-5
C.P点对应溶液中 c(Cl-) =0.05 mol • L-1
D.N点对应溶液pH>7的原因是X-+ H2O
HX+OH-
难度: 困难查看答案及解析