-
下列转化过程不能一步实现的是
A. Al(OH)3→Al2O3 B. Al2O3→Al(OH)3
C. Al→AlCl3 D. Al→NaAlO2
难度: 简单查看答案及解析
-
下列物质属于合金的是
A. 水银 B. 生铁 C. 氧化铝 D. 氢氧化铁
难度: 简单查看答案及解析
-
SO2排放会导致的环境问题是
A. 酸雨 B. 温室效应 C. 臭氧空洞 D. 光化学烟雾
难度: 简单查看答案及解析
-
对储氢材料CaH2描述错误的是
A. 离子半径:H- > Li+ B. H-有强还原性
C. Ca2+ 最外层电子排布式 3s23p6 D. Ca2+在水溶液中不能够大量存在
难度: 简单查看答案及解析
-
下列物质能起消毒杀菌作用的是
A. 生石灰 B. 绿矾 C. 明矾 D. 氯水
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A. 羟基的电子式
B. N原子最外层电子的轨道表示式
C. 乙炔的最简式 CH≡CH
D. 乙烯的结构简式 CH2-CH2
难度: 简单查看答案及解析
-
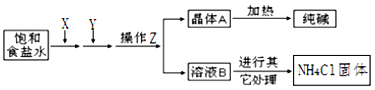
经过浓缩、氧化和提取三步,从海水中获得的物质是
A. 单质溴 B. 单质镁 C. 烧碱 D. 氯化钠
难度: 简单查看答案及解析
-
按照有机物的命名规则,下列命名正确的是
A. 1,2-二甲基戊烷 B. 3,4-二甲基戊烷
C. 2,2-二甲基丁烷 D. 2,3,3-三甲基丁烷
难度: 简单查看答案及解析
-
下列醇不能由烃和水加成制得的是
A.
B.
C.
D.
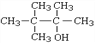
难度: 简单查看答案及解析
-
实验室制取乙炔气体装置错误的是
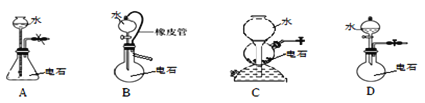
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将少量铝粉投入下列物质中,反应一段时间后无固体残留的是
A. 热的纯水 B. 热的烧碱溶液 C. 冷的浓硫酸 D. 硫酸铜溶液
难度: 简单查看答案及解析
-
某溶液中可能含有K+、Ba2+、Cl-、SO32-。取样,用pH试纸测试,溶液显弱碱性。未确定的离子是
A. K+ B. Ba2+ C. Cl- D. SO32-
难度: 简单查看答案及解析
-
硫酸铜晶体结晶水含量的测定结果,相对误差为-2.67%,其原因可能是
A. 实验时盛放硫酸铜晶体的容器未完全干燥
B. 加热过程中晶体有少量溅失
C. 硫酸铜晶体灼烧后有黑色物质出现
D. 加热后固体未放入干燥器中冷却
难度: 中等查看答案及解析
-
进行下列实验,括号内的实验用品都必须用到的是
A. 硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体)
B. 气体摩尔体积的测定(玻璃棒、镁带和液体量瓶)
C. 钠的焰色反应(铂丝、氯化钠溶液、稀盐酸)
D. 粗盐提纯(蒸发皿、玻璃棒、分液漏斗)
难度: 中等查看答案及解析
-
化工生产中,常用催化剂的作用是
A. 减小反应的热效应 B. 降低生成物的能量
C. 增大反应的完成程度 D. 缩短反应的时间
难度: 简单查看答案及解析
-
下列是常见离子检验的离子方程式,其中错误的是
A. Fe3+:Fe3+ +3SCN-→Fe(SCN)3 ↓ B. SO42-:Ba2++SO42-→BaSO4↓
C. Cl-:Ag++Cl-→AgCl↓ D. NH4+:NH4++OH-
NH3↑+H2O
难度: 简单查看答案及解析
-
用图1表示铜锌原电池中一些物理量的关系。x轴表示流入正极电子的物质的量,则y轴表示
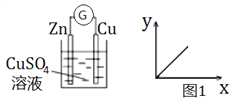
A. c(H+) B. c(SO42-) C. 铜棒的质量 D. 锌棒的质量
难度: 中等查看答案及解析
-
氨水可以用于SCR和SNCR工艺。是用NH3还原剂喷入炉内或烟道内与NOx进行选择性反应,主要反应为:8NH3+6NO2→7N2+12H2O。下列说法错误的是
A. NH3是还原剂 B. H2O是氧化产物
C. 消除1molNO2转移电子为4mol D. NO2是氧化剂
难度: 中等查看答案及解析
-
X、Y、Z和R分别代表四种短周期元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系式一定错误的是
A. b-d=n+m B. 原子序数:b﹥a﹥d﹥c
C. 离子半径:Zn-﹥Rm-﹥Xm+﹥Yn+ D. 原子半径:X﹥Y﹥R﹥Z
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是
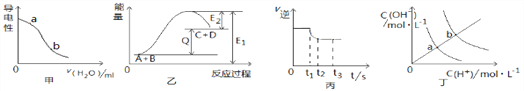
A. 图甲表示向醋酸稀溶液中加水时溶液的导电性变化,图中a点pH小于b点
B. 图乙表示反应A(g)+B(g) → C(g)+D(g) +QKJ
C. 图丙表示合成氨反应的v(逆)随时间变化曲线,由图知t1时刻减小了压强
D. 图丁表示不同温度下水中H+和OH-的浓度变化曲线,图中a点对应的温度低于b
难度: 中等查看答案及解析