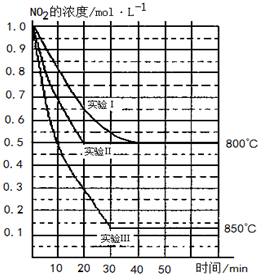
-
某溶液中可能含有Ba2+、I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I- ⑤可能含有Ba2+.
A.①⑤
B.①②③
C.③④
D.②③④难度: 中等查看答案及解析
-
据国外媒体报道,“火星快车”号和“金星快车”号探测器日前分别在火星和金星大气层中发现了一种非常特殊的气态化合物.这种化合物的存在不但会导致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生.它的结构式为:16O=C=18O).下列说法正确的是( )
A.16O2与18O2为同素异形体
B.16O=C=18O与16O=C=16O互为同位素
C.16O=C=18O的物理性质与16O=C=16O相同
D.46g16O=C=18O中含有3NA个原子难度: 中等查看答案及解析
-
H3AsO3与SnCl2在浓盐酸中可发生以下反应:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3M+6H2O 关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3;②还原性:Cl->As;③每生成1mol As,反应中转移电子的物质的量为2mol;④M为SnCl62-;⑤M是氧化产物.
A.①④⑤
B.①②⑤
C.①③④
D.①③⑤难度: 中等查看答案及解析
-
不能实现下列物质间直接转化的元素是( )
单质氧化物
酸或碱
盐.
A.硅
B.硫
C.碳
D.钠难度: 中等查看答案及解析
-
已知H2C2O4是二元弱酸,酸式盐NaHC2O4的溶液呈酸性.30℃时,浓度均为0.1mol•L-1 NaHC2O4溶液和Na2C2O4溶液中均存在的关系是( )
A.c(H+)•c(OH-)=1×10-14
B.c(H+)+c(H2C2O4)=c(C2O42-)+c(OH-)
C.c(Na+)+c(H+)=c(OH-)+c(HC2O4--)+2c(C2O42-)
D.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)难度: 中等查看答案及解析
-
关于下列图示的说法中正确的是( )

A.图①表示可逆反应“CO(g)+H2O(g)⇌CO2(g)+H2(g)”中的△H大于0
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
D.图④量取0.10 mol•L-1KMnO420.00mL难度: 中等查看答案及解析
-
代糖是一种人工合成的甜味剂(sweetener),由于它不会被消化而变为能量供给身体所需,所以适合一些减肥人士食用.目前为止,天冬酰苯丙氨酸甲酯(aspartame)尚未有证据证实它是致癌物质,是糖的最佳代用品,比一般的蔗糖甜160倍.请根据右图结构式判断下列关于aspartame的说法不正确的是( )

A.是芳香族化合物
B.分子式中含有醛基
C.既能与NaOH溶液反应,也能与HCl反应
D.1mol aspartame最多能与3mol NaOH反应难度: 中等查看答案及解析
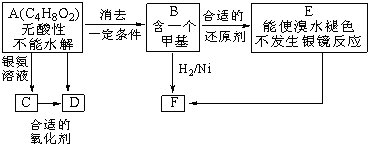
 (注:R、R´为烃基)
(注:R、R´为烃基)