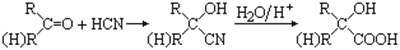
-
两种气态烃的混合气体共1 mol,在空气中燃烧得到1.5 mol CO2和2 mol H2O,关于该混合气体的说法正确的是
A. 一定含有甲烷,不含乙烷
B. 一定含乙烷,不含甲烷
C. 一定是甲烷和乙烯的混合气体
D. 一定含甲烷,但不含乙烯
难度: 简单查看答案及解析
-
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是
A. c(K+)+ c(H+)= c(HC2O4-)+ c(OH-)+ c(C2O42-)
B. c(HC2O4-)+ c(C2O42-)= 0.1 mol·L-1
C. c(C2O42-)> c(H2C2O4)
D. c(K+) = c(H2C2O4)+ c(HC2O4-)+ 2c(C2O42-)
难度: 困难查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是
A. CH3COOH B. Cl2 C. NH4HCO3 D. SO2
难度: 中等查看答案及解析
-
关于冰融化为水的过程判断正确的是
A. ΔH>0,ΔS>0 B. ΔH<0,ΔS>0
C. ΔH>0,ΔS<0 D. ΔH<0,ΔS<0
难度: 中等查看答案及解析
-
常温下下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B. 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+
C. c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+
D. c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42—、SCN-
难度: 简单查看答案及解析
-
下列有机物检验方法正确的是
A. 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在
B. 用溴水鉴别乙烯与乙炔
C. 用溴水检验溴乙烷与NaOH醇溶液共热后的产物是否是乙烯
D. 用NaOH水溶液来鉴别二氯乙烷和三氯乙烷
难度: 简单查看答案及解析
-
下列说法正确的是
A. 在一定温度下AgCl水溶液中Ag+和Cl-浓度的乘积是一个常数
B. AgCl水溶液的导电性很弱,所以AgCl为弱电解质
C. 温度一定时,当AgCl水溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
D. 向饱和AgCl水溶液中加入盐酸,c(Cl-)增大,Ksp值变大
难度: 中等查看答案及解析
-
有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
A. 在三种酸HX、HY、HZ中以HX酸性相对最强
B. HX、HY、HZ三者均为弱酸
C. 在X-、Y-、Z-三者中,以Z-最易发生水解
D. 中和1molHY酸,需要的NaOH小于1mol
难度: 困难查看答案及解析
-
下列关系式正确的是
A. 常温下pH=2的甲酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(HCOO-)>c(OH-)>c(H+)
B. 0.1mol/LNa3PO4溶液中:c(OH-) - c(H+)= c(HPO42-)+2c(H2PO4-)+3c(H3PO4)
C. Na2CO3溶液加水稀释后,恢复至原温度,所有离子浓度均减小
D. 0.1 mol.L-1 pH=4的NaHB的溶液中,c(Na+) >c(HB- )> c(H2 B)>c(B2-)
难度: 中等查看答案及解析
-
下列说法正确的是
A. 质谱、红外光谱都能够快速、精确地测定有机物的相对分子质量
B. 核磁共振氢谱中,CH3COOH、CH3OH都可给出两种信号
C.
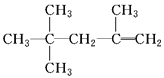 的名称为2,2,4三甲基4戊烯
的名称为2,2,4三甲基4戊烯D.
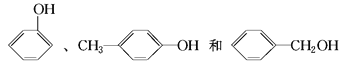 互为同系物
互为同系物难度: 简单查看答案及解析
-
在100 mL 0.01 mol·L-1KCl溶液中,加入1 mL 0.01 mol· L-1AgNO3溶液,下列说法正确的是(已知AgCl的Ksp=1.8×10-10)( )
A. 有AgCl沉淀析出 B. 无AgCl沉淀析出
C. 无法确定 D. 有沉淀但不是AgCl
难度: 简单查看答案及解析
-
将浓度为0.1mol/L=HF溶液加水不断稀释,下列各量始终保持增大的是
A. c(H+) B. Ka(HF) C.
D.
难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=
mol·L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
难度: 中等查看答案及解析
-
在一定条件下,对于反应mA(g)+nB(g)
cC(g)+dD(g),C物质的浓度(C%)与温度、压强的关系如图所示,下列判断正确的是
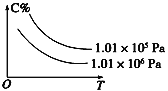
A. ΔH<0 ΔS>0
B. ΔH>0 ΔS<0
C. ΔH>0 ΔS>0
D. ΔH<0 ΔS<0
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大
B. 平衡向正反应方向移动
C. D的体积分数变大
D. a < c+d
难度: 中等查看答案及解析
-
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)
2Z(g)+W(s) ΔH<0,下列叙述正确的是
A. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
B. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
C. 达到平衡时,反应速率v正(X)=2v逆(Z)
D. 平衡常数K值越大,X的转化率越大
难度: 简单查看答案及解析
-
对于苯乙烯的结构简式如下所示,的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面。其中完全正确的是
A. ①②④ B. ①②④⑥
C. ①②④⑤⑥ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为
A. 60% B. 91% C. 84% D. 42%
难度: 中等查看答案及解析
-
某有机物的结构简式如图,下列结论正确的是( )
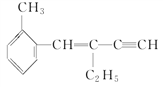
A. 该有机物分子式为C13H16
B. 该有机物属于苯的同系物
C. 该有机物分子中至少有4个碳原子共直线
D. 该有机物分子中最多有13个碳原子共平面
难度: 中等查看答案及解析