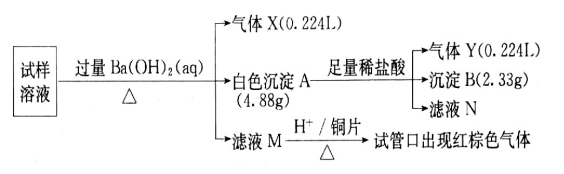
-
“化学与社会、生活、科研密切的关系”。下列叙述中,不正确的是
A.大量使用燃煤发电是形成雾霾的主要原因
B.天然气、煤气大量泄漏遇到明火会爆炸
C.利用化学反应可实现12C到14C的转化
D.晶体硅可用于光伏发电、制造芯片
难度: 简单查看答案及解析
-
下列叙述正确的是
A.元素的单质可由氧化或还原含该元素的化合物来制得
B.得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,只能做氧化剂
D.含有最高价元素的化合物一定具有强的氧化性
难度: 中等查看答案及解析
-
下列有关实验的做法错误的是
A.用苯从溴水中提取溴,有机层从分液漏斗的上口倒出
B.实验室可以用浓氨水和生石灰制备NH3
C.实验室中用加热方法分离碘和食盐的混合物
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
难度: 中等查看答案及解析
-
下列叙述正确的是
A.非金属氧化物一定不是碱性氧化物
B.HCl、H2S、NH3都是电解质
C.漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用于物质分离
D.Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备
难度: 中等查看答案及解析
-
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸; ②用酒精洗涤粘有硫粉的试管;
③用托盘天平称量10.1 g氯化钠晶体; ④用饱和NaHCO3溶液除之CO2中的少量SO2;
⑤用瓷坩埚熔融NaOH固体; ⑥实验中不慎将手指划破,可立即用FeCl3溶液止血
A.①②③④ B.③④⑥
C.③④⑤ D.③⑤⑥
难度: 中等查看答案及解析
-
下列实验装置、选用的试剂或实验操作中,都正确的是
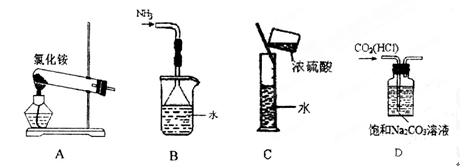
A.实验室用装置A制取氨气 B.用B装置吸收氨气,并防止倒吸
C.用C装置稀释浓硫酸 D.用D装置除去CO2中的HCl
难度: 中等查看答案及解析
-
下表中关于物质分类的正确组合是
类别组合
酸性氧化物
碱性氧化物
酸
碱
盐
A
CO2
CuO
H2SO4
NH3·H2O
Na2S
B
CO
Na2O
HCl
NaOH
NaCl
C
SO2
Na2O2
CH3COOH
KOH
CaF2
D
NO2
CaO
HNO3
Cu2(OH)2CO3
CaCO3
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.5.6g铁粉在0.1mol氯气中充分燃烧,转移电了数为0.3NA
B.7.8gNa2S和 Na2O2的固体混合物中含有的阴离子数大于0.1NA
C.50mL l8.4mol·L-1浓浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA
D.常温常压下,46gNO2和N2O4的混合物中含有2NA个氧原子
难度: 困难查看答案及解析
-
对下列实验操作和事实的解释正确的是
A.某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为Cl2有强氧化性
B.向氯水中加入碳酸氢钠粉末,有气泡产生,说明氯水中含有H+
C.配制一定物质的量浓度的溶液发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO
、S2-、SO
难度: 中等查看答案及解析
-
下列有关实验的说法正确的是
A.除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.制取Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32—
难度: 中等查看答案及解析
-
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确是
A.加入KSCN溶液一定不变红色
B.溶液中一定含Cu2+
C.溶液中一定含Fe2+
D.剩余固体中一定含铜
难度: 中等查看答案及解析
-
等质量的下列物质与足量浓盐酸反应,放出Cl2物质的量最多的是
A.KMnO4 B.MnO2 C.NaClO3 D.NaClO
难度: 中等查看答案及解析
-
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnsO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应中NaHSO4均为氧化产物
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO
>IO
>I2
D.反应①、②中生成等量的I2时转移电子数比为1:5
难度: 中等查看答案及解析
-
将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A.11.20L B.15.68L C.22.40L D.31.36L
难度: 中等查看答案及解析
-
还原2.4×10-3 mol [XO(OH)3]+ 到X元素的低价态时,消耗0.2mol·L—1的Na2SO3溶液30 mL,则X元素反应后的价态是
A.-1 B.+1 C.0 D.-2
难度: 中等查看答案及解析