-
分别称取2.39 g (NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]∶n(NH4Cl)为______________________。

(2)另一
份固体混合物中NH
与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=____(溶液体积变化忽略不计)。
难度: 中等查看答案及解析
-
为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号
Ⅰ
Ⅱ
Ⅲ
Ⅳ
盐酸体积(mL)
30.0
30.0
30.0
30.0
样品质量(g)
2.96
3.70
5.18
6.66
CO2体积(mL)
672
840
896
672
(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=________。
难度: 中等查看答案及解析
-
现有48.4 g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150 mL某浓度的盐酸中,充分反应后生成CO2 4.48 L(已折算成标准状况下),所得溶液稀释至250 mL,测得溶液的c(H+)=0.100 mol·L-1。
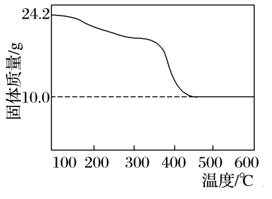
按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=________mol·L-1。
(2)x∶y∶z=________。
难度: 中等查看答案及解析
-
铁粉、铜粉混合物样品11.6 g,逐滴加入2.0 mol·L-1的硫酸溶液,充分反应后剩余固体质量随加入硫酸溶液体积变化如下表:
硫酸溶液/mL
20.0
40.0
60.0
80.0
剩余固体/g
9.36
7.12
4.88
3.20
请回答:
(1)样品中铁与铜的物质的量之比n(Fe)∶n(Cu)=________。
(2)在反应后的体系中,再加入4.0 mol·L-1的H2O2溶液25.0 mL,并加入足量硫酸溶液。充分反应后溶液中存在的各金属离子的物质的量分别是多少?__________________________________________。
难度: 中等查看答案及解析
-
实验室用100 mL 0.500 mol·L-1的NaOH溶液捕获CO2,一定时间后,测定CO2的吸收量。方法是用盐酸逐滴加入到吸收CO2后的溶液中,产生的CO2气体的物质的量与加入盐酸的体积示意图如下:
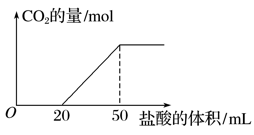
求:(1)吸收的CO2在标准状况下的体积是________ mL。
(2)盐酸的物质的量浓度是________mol·L-1。
难度: 中等查看答案及解析
-
小茗同学用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(其中盐酸的物质的量浓度相等,且忽略HCl的挥发,气体体积均为标准状况下的体积)。
试回答:
实验序号
第1组
第2组
第3组
第4组
盐酸体积/mL
50.00
50.00
50.00
50.00
混合物质量/g
3.060
6.120
9.180
12.24
生成气体体积/mL
672
1 344
1 568
1 344
(1)所用盐酸的物质的量浓度为__________。
(2)第4组实验至少还需加入________________ mL的该盐酸才能完全反应。
难度: 中等查看答案及解析
-
将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。将其中的一份直接加热
至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0 mL。试计算:
(1)原均匀混合物中NaHCO3的物质的量n(NaHCO3)=________________ mol。
(2)盐酸的浓度c(HCl)=________ mol·L-1。
难度: 中等查看答案及解析
-
实验室通常用氧化剂+浓盐酸―→金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入50 mL 12.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
(1)反应过程中,被氧化的HCl的物质的量为________ mol。
(2)反应后溶液中HCl的物质的量浓度为______mol·L-1。
难度: 中等查看答案及解析
-
室温下,取50 mL H+浓度为0.2 mol·L-1的盐酸和硫酸的混合溶液,加入50 mL Ba(OH)2溶液充分反应,得到沉淀0.233 g,反应后溶液中OH-浓度为0.01 mol·L-1(假设反应后溶液的总体积为100 mL)。
请计算:
(1)原混合酸溶液中H+的物质的量为__________ mol。
(2)加入的Ba(OH)2溶液的物质的量浓度为__________ mol·L-1。
难度: 中等查看答案及解析
-
取表面有铁锈(Fe2O3)的铁片22.0 g,将其投入足量稀硫酸中,铁片完全溶解,产生氢气4.48 L(标准状况)。试计算:
(1)产生氢气的物质的量是________________ mol。
(2)铁片中铁的质量是__________________ g。
难度: 中等查看答案及解析
-
有50 mL NaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10 mL将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的HCl溶液,产生的CO2气体
体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
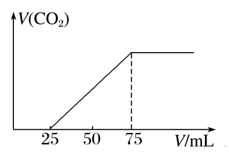
试分析:
(1)通入CO2后溶液中的溶质为________________。
(2)原NaOH溶液物质的量浓度为
________________。
难度: 困难查看答案及解析
-
某碳酸钠
和碳酸氢钠混合物,取m g固体样品进行加热,完全分解产生CO2112 mL;另取m g固体样品溶于水,向所得溶液中逐滴加入150 mL稀盐酸时产生CO2 112 mL,过量时产生CO2 448 mL(气体体积均为标准状况下测定)。
(1)碳酸氢钠与碳酸钠的物质的量之比为____________________________________________。
(2)盐酸物质的量浓度为______________(保留2位有效数字)。
难度: 中等查看答案及解析
-
钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末;
②取m g该粉末,放入28.00 mL 1 mol·L-1的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
完成下列各题:
(1)将反应
后的溶液稀释至100 mL,则溶液中c(Fe2+)=________mol·L-1。
(2)样品中n(Fe)∶n(Fe3O4)=__________。
难度: 中等查看答案及解析
-
向某石灰乳中缓慢通入氯气,随着反应的进行,温度升高开始产生Ca(ClO3)2。ClO-、ClO
两种离子的物质的量(n)与反应时间(t)的关系曲线如图所示(不考虑氯气和水的反应)。

(1)由图可知ClO-、ClO
两种离子的物质的量之比为__________。
(2)所取石灰乳中含有Ca(OH)2的物质的量为______mol。
难度: 中等查看答案及解析
-
化学需氧量(chemical oxygen demand,简称COD)表示在强酸性条件下重铬酸钾氧化一升污水中有机物所需的氧化剂的量,并换算成以氧气为氧化剂时,1 L水样所消耗O2的质量(mg·L-1)计算。COD小,水质好。某湖面出现赤潮,某化学兴趣小组为测定其污染程度,用1.176 g K2Cr2O7固体配制成100 mL溶液,现取水样20.00 mL,加入10.00 mL K2Cr2O7溶液,并加入适量酸和催化剂,加热反应2 h。多余的K2Cr2O7用0.100 0 mol·L-1Fe(NH4)2(SO4)2溶液12.00 mL恰好反应完,此时
,发生的反应是Cr2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
(已知K2Cr2O7和有机物反应时被还原为Cr3+,K2Cr2O7的相对分子质量为294)
(1)K2Cr2O7溶液的物质的量浓度为______________ mol·L-1。
(2)求该湖水的COD为____________mg·L-1。
难度: 困难查看答案及解析