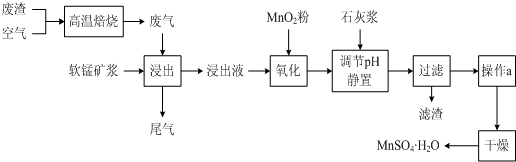
-
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol•L-1
B.加入Na2CO3固体,可能生成沉淀
C.所加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10mol•L-1难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关.下列说法中,你认为正确的是( )
A.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
B.加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性
C.铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获取铝
D.可用铝制容器存放浓硝酸,是因为常温下浓硝酸与铝不反应难度: 中等查看答案及解析
-
下列关于有机物说法正确的是( )
A.制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
B.用灼烧的方法可以区别丝和棉花
C.油脂水解可得到氨基酸和甘油
D.纤维素和淀粉都是多糖,二者互为同分异构体难度: 中等查看答案及解析
-
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾.撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应是放热反应
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.该反应氧化剂与还原剂物质的量之比为6:5
D.上述反应中消耗3molP时,转移电子的物质的量为15mol难度: 中等查看答案及解析
-
右图中,M、N为含X元素的常见化合物.则X元素为( )

A.Fe或C
B.Cu或Fe
C.N或S
D.C或Al难度: 中等查看答案及解析
-
对于下列各种溶液中,微粒的物质的量浓度关系表述正确的是( )
A.在25℃100mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3∙H2O)
B.0.1mol•L-1的NaHSO3溶液中:c(Na+)=c(HSO3-)+c(H2SO3)+2c(SO32-)
C.将0.2mol•L-1 NaA溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等难度: 中等查看答案及解析
-
煤化工生产中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡常数随温度的变化如表:
则下列说法错误的是( )温度/℃ 400 500 830 1000 平衡常数K 10 9 1 0.6
A.在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50%
B.上述正向反应是放热反应
C.某温度下上述反应平衡时,恒容、升高温度,原化学平衡向逆反应方向移动
D.在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小难度: 中等查看答案及解析