-
下列说法正确的是( )
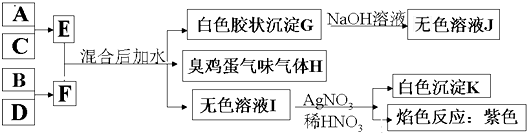
①漂白粉、水玻璃和铝热剂都是混合物;
②煤的干馏和石油的分馏都是化学变化;
③氨基酸、纯碱、芒硝和生石灰分别属于酸、碱、盐和氧化物;
④乙醇中混有乙酸,可先加足量生石灰后再蒸馏.
A.①④
B.①③
C.②④
D.③④难度: 中等查看答案及解析
-
下列反应所得到的有机产物不是纯净物的是( )
A.新戊烷与氯气在光照条件下的取代反应
B.乙烯与水在一定条件下的加成反应
C.CH3CH2OH在空气中加热(以铜作为催化剂)的氧化反应
D.苯与足量的氢气在一定条件下的加成反应难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-Mn2++Cl2↑+2H2O
C.将Fe2O3溶解于足量H+溶液:Fe2O3+6H+=2Fe3++3H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
A.28g乙烯分子中含有极性共价键的数目为6NA
B.一定条件下,0.1molCu与0.1molI2充分反应,转移的电子数一定为0.2NA
C.标准状况下,11.2L以任意比例混合的NO和O2的混合气体中所含原子个数为NA
D.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA难度: 中等查看答案及解析
-
下列图象与文字描述正确的是( )
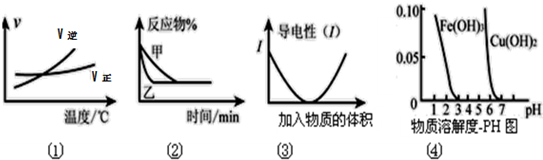
A.根据图①可判断对于“A2(g)+3B2(g)⇌2AB3(g)”:升温,化学反应平衡常数增大
B.图②表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响且P甲<P乙
C.图③可表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu(OH)2至溶液的pH在4左右即可难度: 中等查看答案及解析
-
下列叙述正确的是( )
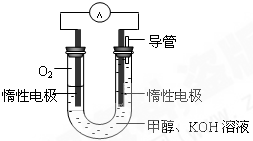
A.可用于电动汽车的铝-空气燃料电池,通常用NaOH溶液做电解液,其正极反应为:O2+2H2O+4e-═4OH-
B.常温下,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度均为1×10-9mol•L-1
C.溴化钠溶液中加入少量新制氯水充分反应后,再加入少量苯振荡静置后上层颜色变浅,下层颜色变为橙红色
D.导电、缓慢氧化、品红褪色和久置浓硝酸变黄都一定属于化学变化难度: 中等查看答案及解析
-
铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL 的NO2气体和336mL的N2O4气体(均为标准状况下),在反应后的溶液中加入足量的NaOH溶液,生成的沉淀的质量为( )
A.7.04g
B.8.26g
C.8.51g
D.9.02g难度: 中等查看答案及解析