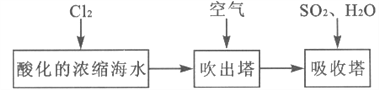
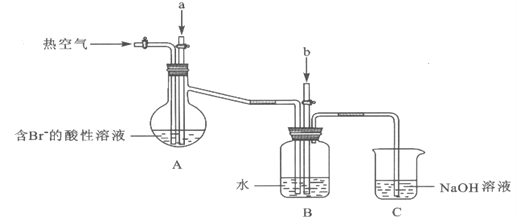
-
将纯水加热至较高温度,下列叙述正确的是
A、水的离子积变大,pH变小,呈酸性
B、水的离子积不变,pH不变,呈中性
C、水的离子积变小,pH变大,呈碱性
D、水的离子积变大,pH变小,呈中性
难度: 简单查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用.下列说法正确的是( )
A. 用米汤检验含碘盐中的碘元素
B. 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多
C. 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉
D. 除去CuSO4溶液中的Fe2(SO4)3,加入足量CuO粉末,充分搅拌过滤
难度: 中等查看答案及解析
-
含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是( )
A. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=+28.7kJ/mol
B. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-28.7kJ/mol
C. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=+57.4kJ/mol
D. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.4kJ/mol
难度: 中等查看答案及解析
-
NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述中不正确的是( )
A. 降低压强能加快化学反应速率
B. 使用适当催化剂可以加快化学反应速率
C. 升高温度能加快化学反应速率
D. 增大压强可以加快此反应的速率
难度: 简单查看答案及解析
-
在一个5L的容器里,盛有8.0mol某气态反应物,5min后,测得这种气态反应物还剩余3.0mol,则这种反应物在此时间内的化学反应速率为( )
A. 0.1mol/(L•min) B. 0.2mol/(L•min)
C. 0.3mol/(L•min) D. 0.4mol/(L•min)
难度: 简单查看答案及解析
-
对于处于化学平衡状态的反应CO+H2O(g)
CO2+H2中,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是( )
A. K正反应=K逆反应 B. K正反应>K逆反应
C. K正反应<K逆反应 D. K正反应×K逆反应=1
难度: 简单查看答案及解析
-
对于达到平衡状态的可逆反应:N2+3H2
2NH3(正反应为放热反应)下列叙述中正确的是
A. 反应物和生成物的浓度相等
B. 反应物和生成物的浓度不再发生变化
C. 降低温度,平衡混合物里氨气的浓度减小
D. 增大压强,不利于氨的合成
难度: 中等查看答案及解析
-
体积相同、pH也相同的H2SO4溶液和HCl溶液,分别与NaOH溶液中和反应时两者消耗NaOH的物质的量( )
A. 相同 B. H2SO4溶液消耗的NaOH多
C. HCl溶液消耗的NaOH多 D. 无法比较
难度: 简单查看答案及解析
-
常温下,下列物质的水溶液,其pH小于7的是
A. Na2CO3 B. NH4NO3 C. Na2SO4 D. KNO3
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是 ( )
A. 以石墨为电极电解MgCl2溶液:2Cl—+2H2O
Cl2+H2↑+2OH—
B. CuC12溶液中加入氨水:Cu2++2OH- Cu(OH)2↓
C. KI溶液中滴入稀硫酸,空气中振荡:4H++4I-+O2 2I2+2H2O
D. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH
+OH-
NH3↑+H2O
难度: 中等查看答案及解析
-
下列4组实验操作或装置图(略去部分夹持仪器)中,有错误的图有( )个
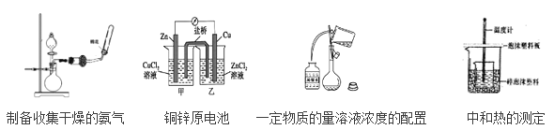
A. 1 B. 2 C. 3 D. 4
难度: 简单查看答案及解析
-
某有机物的结构为
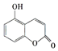 ,下列有关说法正确的是 ( )
,下列有关说法正确的是 ( )A. 1 mol该物质与足量浓溴水反应,最多消耗2 molBr2
B. 1mol该物质最多能与2mol NaOH反应
C. 1 mol该物质最多能与3 mol H2加成
D. 该物质的核磁共振氢谱共有6个吸收峰
难度: 中等查看答案及解析
-
某有机物的结构简式如图
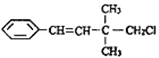 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )A. 一定条件下,能发生加聚反应
B. 1mol该有机物在一定条件下最多能与4molH2发生反应
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 该有机物苯环上的一溴代物有3种
难度: 简单查看答案及解析
-
某有机物A是农药生产中的一种中间体,其结构简式如图所示,下列叙述正确的是( )

A. 有机物A属于芳香烃
B. 有机物A可以和Br2的CCl4溶液发生加成反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1mol A和足量的NaOH溶液反应,可以消耗3mol NaOH
难度: 中等查看答案及解析