-
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
A.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
C.2012年3月修订的《环境空气质量标准》中新纳入的监测指标是PM2.5
D.防止酸雨发生的重要措施之一是使用清洁能源难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
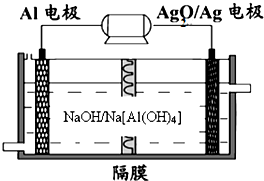
B.2L 0.05 mol•L-1乙酸溶液中H+数为0.1NA(NA为阿伏加德罗常数)
C.SO2溶于水,其水溶液能导电,说明SO2是电解质
D.常温下在pH=1的溶液中Na+、NH4+、[Al(OH)4]-、SO42-可以大量共存难度: 中等查看答案及解析
-
元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是( )
A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
B.某微粒的结构示意简图为,则该元素在周期表中位于第三周期、VIA族
C.Be(OH)2的碱性比Mg(OH)2的碱性强
D.原子半径:Na>Si>O难度: 中等查看答案及解析
-
下列与有机物的结构、性质有关的叙述不正确的是( )
A.甲烷和乙烯都可以与氯气反应,反应类型不同
B.蔗糖、油脂、蛋白质都可以水解
C.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
D.乙醇和乙酸都存在碳氧双键,二者可以发生酯化反应难度: 中等查看答案及解析
-
下列药品和装置合理且能完成相应实验的是( )
A.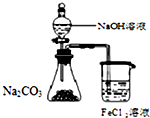
制备氢氧化亚铁
B.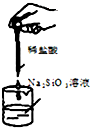
验证非金属性Cl>C>Si
C.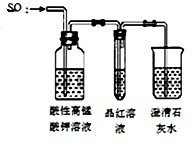
检验二氧化硫中是否混有二氧化碳
D.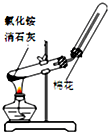
实验室制取并收集氨气难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.过量的铜与浓硝酸反应,生成的气体只有NO2难度: 中等查看答案及解析
-
有关下列图象的说法正确的是( )
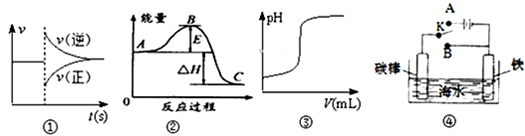
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.根据图②判断,物质A反应生成物质C的△H>0
C.曲线图③可表示向一定量的硫酸溶液中滴加一定浓度氢氧化钠溶液时的pH值变化
D.开关K置于A或B处均可减缓铁的腐蚀难度: 中等查看答案及解析