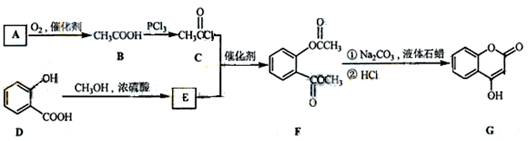
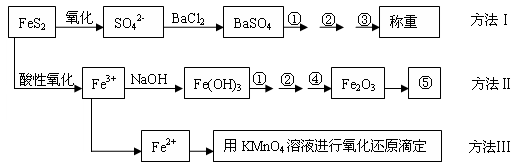
-
化学在人类生活中扮演着重要角色,以下应用正确的是( )
A.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的
B.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂
C.使用无磷洗衣粉,可彻底解决水体富营养化问题
D.天然药物无任何毒副作用,可长期服用
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.硫酸亚铁铵晶体过滤后用无水乙醇洗涤,阿司匹林晶体过滤后用水洗涤
B.在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断氯元素的存在
C.中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
D.纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度慢一些
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+==Ca2++H2O+CO2
B.硫化钠溶于水中:S2-+2H2O
H2S+2OH-
C.过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D.用铜作电极电解饱和硫酸铜溶液:Cu+2H2O
Cu(OH)2+H2↑
难度: 中等查看答案及解析
-
下列说法错误的是 ( )
A.2,3—二甲基—4—乙基己烷的名称是正确的
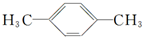
B.如图为对—二甲苯,结构中核磁共振氢谱出现两组峰,其氢原子数之比为 3:2
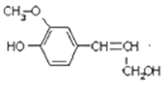
C.木质素的一种单体结构简式如右图所示每摩尔该物质最多能消耗3molBr2
D.合成顺丁橡胶(
)的单体是CH2=CH—CH=CH2
难度: 中等查看答案及解析
-
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
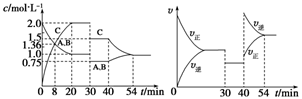
下列说法中正确的是( )
A.30~40 min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
难度: 困难查看答案及解析
-
下列有关叙述正确的是 ( )
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+)
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中
不变
D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
难度: 困难查看答案及解析
-
某无色溶液中含有K+,Cl-,OH-,SO32-,SO42-,为了检验除OH-外的其它所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象:
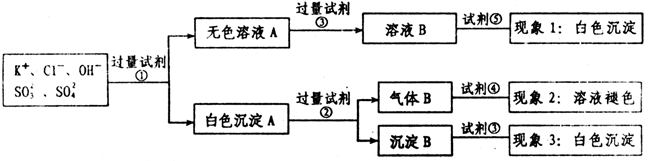 下列有关结论错误的是 ( )
下列有关结论错误的是 ( )A.试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl
B.现象3中白色沉淀是BaSO4
C.试剂②是盐酸,试剂③是硝酸
D.产生现象2的离子方程式是:Br2+2H2O+SO2=4H++2Br-+SO42-
难度: 困难查看答案及解析