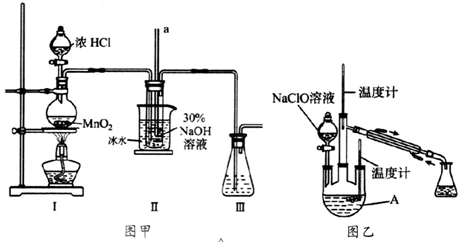
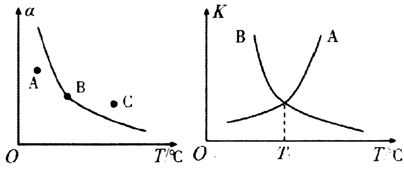
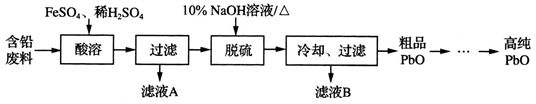
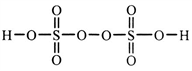-
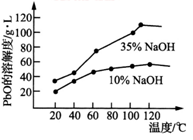
化学与生产、生活与环境密切相关。下列说法错误的是
A. 为了防止白色污染应回收废旧塑料并加以焚烧
B. 手机壳上贴的碳纤维膜是一种新型无机非金属材料
C. 当今雾霾天气频发是由于人类活动对自然环境的影响所造成的
D. 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 在含A13+总数为NA的A1C13溶液中,C1-总数为3NA
B. 标准状况下,5.6L CO2中含有的共用电子对数为0.5NA
C. Na2O2与足量的CO2反应生成0.1mol O2,转移的电子数为0.2NA
D. 常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子
难度: 中等查看答案及解析
-
下列说法正确的是
A. 分子式为C6H14O的醚有15种
B. 将气体通过酸性高锰酸钾溶液可提纯含有乙烯杂质的乙烷
C. 分馏、干馏都属于物理变化,裂化、裂解都属于化学变化
D. 聚乙烯、橡胶、聚酯纤维都是通过加聚反应制得的高分子化合物
难度: 困难查看答案及解析
-
下列实验操作能达到实验目的的是
选项
实验目的
操作方法
A
除去溴苯中的溴
将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液
B
制备氢氧化铁胶体
在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸
C
除去Cl2中少量HCl
将混合气体通过盛有饱和碳酸氢钠溶液的洗气瓶
D
验证CH3COONa溶液中存在水解平衡
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
磷酸铁锂(LiFePO4)电池是一种高效、环保的新型电池,装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐,电池工作时的总反应为:LiFePO4+6C
Li1-xFePO4+LixC6,则下列说法错误的是
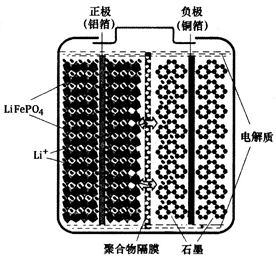
A. 装置中的聚合物隔膜应为阳离子交换膜
B. 充电时,Li+迁移方向为由右向左
C. 充电时,LiFePO4中的铁元素被氧化
D. 放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-=LiFePO4
难度: 困难查看答案及解析
-
已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
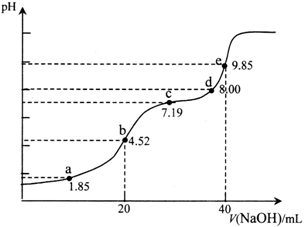
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
难度: 困难查看答案及解析