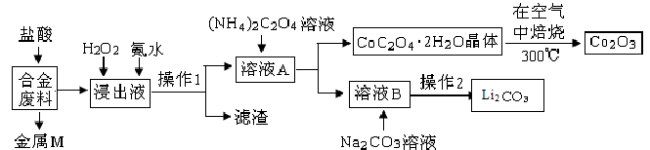
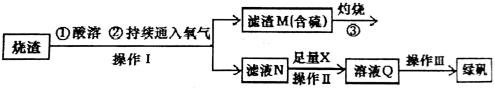
-
化学与人类生活、生产和社会可持续发展密切相关,下列叙述正确的是( )
A.水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐工业产品
B.氧化铝和氧化镁都是电解质,工业上可用于电解制取铝和镁
C.用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体
D.静电除尘、燃煤固硫、汽车尾气催化净化都可以提高空气质量
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A
.1 mol Cu与足量的硫反应转移电子数为2 NA
B.将1 mol HCl通入2 mol H2O中,溶液中的分子
数为3 NA
C.5.8 g丁烷中存在共价键总数为1.3 NA
D.标准状况下,22.4 L甲烷和22.4 L水含有的电子数均为10 NA
难度: 简单查看答案及解析
-
用下列实验装置进行相应地实验,能达到实验目的的是( )
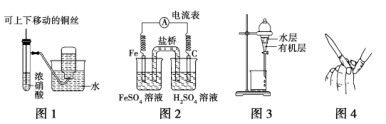
A.图1用于制备并收集少量NO2气体
B.图2是原电池装置,Fe电极为负极
C.图3用于提取I2/CCl4溶液中的I2
D.图4用于检查碱式滴定管是否漏液
难度: 简单查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期元素,甲是由其中的三种元素组成的化合物,0.1 mol·L-1甲溶液的pH为13(25℃),Y元素形成的简单离子能促进水的电离,下列说法正确的是( )
A. X、Y、Z形成的简单离子的半径大小顺序为:Z>Y>X
B. X、Y非金属性:X>Y
C. W与Y形成的化合物易溶于水,是强电解质
D. W、Z分别与X都能形成具有强氧化性的化合物
难度: 简单查看答案及解析
-
已知热化学方程式:H2(g)+2ICl(g)=2HCl(g)+I2(g) △H = a kJ·mol-1。其反应过程如下:
①H2(g)+ICl(g)=HClI(g)+H(g) (慢)
②H(g)+ICl(g)=HCl(g)+I(g) (快)
③HClI(g)=HCl(g)+I(g) (快)
④I(g)+I(g)=I2(g) (快)
下列说法不正确的是( )
A.总反应的速率由反应①的速率决定
B.反应④的焓变小于0
C.HClI是上述总反应的催化剂
D.正反应活化能Ea1与逆反应活化能Ea2之差为a kJ·mol-1
难度: 简单查看答案及解析
-
C5H9OCl含有2个甲基、1个醛基、1个氯原子的同分异构体共有( )
A.5种 B.6种 C.7种 D.8种
难度: 简单查看答案及解析
-
常温下,0.2 mol·L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中
部分微粒组成及浓度如图所示,下列说法正确的是( )
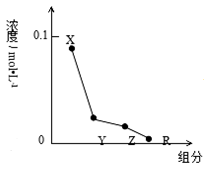
A.MOH的电离方程式:MOH=M++OH-
B.该混合溶液中水电离出的c(H+)<10-7mol·L-1
C.该混合溶液中:c(Y)+c(X)=c(R)+c(Z)
D.图中c(X)+c(Z)=0.1mol·L-1
难度: 简单查看答案及解析