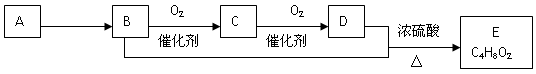
-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
难度: 简单查看答案及解析
-
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
难度: 简单查看答案及解析
-
下列物质不能发生水解反应的是
A.油脂 B.麦芽糖 C.葡萄糖 D.蛋白质
难度: 简单查看答案及解析
-
在体积不变的密闭容器中发生的反应是CO(g)+H2O(g)
CO2(g)+H2(g)下列情况中,能说明该反应达到化学平衡状态的是
A.混合气体的密度不再改变 B.混合气体的质量不再改变
C.混合气体的物质的量不再改变 D.CO的浓度不再改变
难度: 简单查看答案及解析
-
苯乙烯的结构简式为
,它不可能具有的性质是
A.易溶于水 B.使溴水褪色
C.发生加成反应 D.使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
下列化合物中可发生加成反应,还能使KMn04酸性溶液褪色的是
A.甲苯 B.乙醇 C.丙烯 D.苯
难度: 简单查看答案及解析
-
下列化合物分子中的所有原子一定都处于同一平面的是
A.溴苯 B.对二甲苯 C.氯乙烯 D.丙烯
难度: 简单查看答案及解析
-
国际无机化学命名委员会1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列,下列说法正确的是
A.第1列元素种类最多
B.第1列元素和第17列元素单质的熔沸点高低的变化趋势相反
C.第14列元素形成的化合物种类最多
D.尚未发现的第113号元素在第七周期第13列
难度: 简单查看答案及解析
-
利用下列各组中的物质制备并收集少量相应的气体,能采用下图装置的是
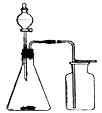
①浓氨水和固体NaOH制NH3 ②大理石和稀盐酸制CO2
③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO
⑤浓盐酸和二氧化锰制Cl2 ⑥锌粒和稀硫酸制H2
A.②③ B.①⑥
C.②③⑤⑥ D.①④⑥
难度: 简单查看答案及解析
-
已知反应A+B==C+D的能量变化如图所示,下列说法正确的是
A.形成产物C和D的化学键所放出的总能量高于断开反应物A 和B的化学键所吸收的总能量
B.该反应只有在加热条件下才能进行
C.反应物的总能量高于产物的总能量
D.该反应为吸热反应
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ- 都具有相同电子层结构,下列关系正确的是
A.离子的还原性:Y2->Z- B.质子数:c>b
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
难度: 简单查看答案及解析
-
两种气态烃组成的混合物共0.1mol,完全燃烧后得到3.85LCO2(标准状况)和3.6g水,下列说法正确的是
A.一定有甲烷 B.一定没有乙烷 C.一定有乙烯 D.一定有乙炔
难度: 简单查看答案及解析
-
下列说法正确的是
A.乙烯分子中碳碳双键键能是乙烷分子中碳碳单键键能的两倍,因此结构稳定
B.除去乙醇中的微量水可加入金属钠,使其完全反应
C.用苯可以萃取溴水中的溴,分液时水层从下端放出。
D.可用饱和NaOH溶液出去乙酸乙酯中混有的乙酸和乙醇。
难度: 简单查看答案及解析
-
在盛有稀 H2SO4 的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.正极附近的 SO4 2- 离子浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.锌片是正极 D.铜片上有 H2 逸出
难度: 简单查看答案及解析
-
巴豆酸的结构简式为CH3—CH=CH—COOH。现有①氯化氢、②溴水、
③纯碱溶液、④丁醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是
A.只有②④⑤ B.只有①③④
C.只有①②③④ D.全部
难度: 简单查看答案及解析