-
下列说法正确的是( )
A.水晶、玛瑙的主要成分是二氧化硅
B.明矾、漂白粉、臭氧的净水原理相同
C.煤的干馏和石油的分馏都属于物理变化
D.亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制难度: 中等查看答案及解析
-
下列解释事实的化学方程式或离子方程式不正确的是( )
A.钢铁发生吸氧腐蚀:2Fe+O2+2H2O═2Fe(OH)2
B.SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32-
C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O
D.84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+=Cl2↑+H2O难度: 中等查看答案及解析
-
下列有关化学实验的叙述中,不正确的是( )
A.用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率
B.制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出
C.制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用氢氧化钠溶液收集产物
D.重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同.下列说法不正确的是( )
A.原子序数:Y>X>Z
B.碱性:XOH>Y(OH)3
C.单质的还原性:X>Y
D.离子半径:X+>Y3+>Z2-难度: 中等查看答案及解析
-
下列各组物质充分反应后,只能得到一种气体的是( )
A.木炭和浓硫酸共热
B.Na2O2与足量的稀硫酸反应
C.足量的铜跟一定量的浓硝酸反应
D.汽油在汽车发动机中燃烧后排出的气体难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.等质量的乙烯和丙烯中含有的共用电子对数目相等
B.等质量的 14NO和 13CO气体中含有的中子数相等
C.10.6 g Na2CO3固体中含阴阳离子总数约为1.806×1023
D.5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等难度: 中等查看答案及解析
-
有关下列四个常用电化学装置的叙述中,正确的是( )
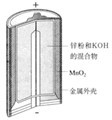
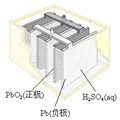
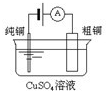
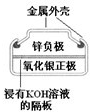
图Ⅰ碱性锌锰电池 图Ⅱ铅-硫酸蓄电池 图Ⅲ电解精炼铜 图Ⅳ银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag难度: 中等查看答案及解析
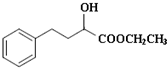 ,合成E和高分子树脂N的路线如图所示:
,合成E和高分子树脂N的路线如图所示: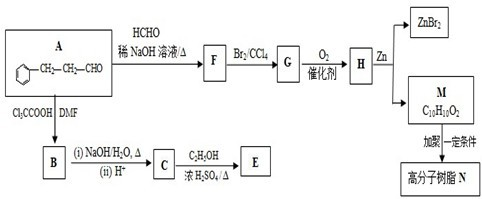
 ,下列有关X的说法正确的是________(填标号).
,下列有关X的说法正确的是________(填标号).