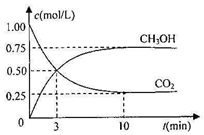
-
下列叙述不正确的是
A.天然气、液化石油气、汽油的主要成分均为烃
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的物质的量相等
C.淀粉、油脂和蛋白质在一定条件都能水解
D.“地沟油”不能食用,但可以制生物柴油或肥皂
难度: 中等查看答案及解析
-
发射“嫦娥二号”的长征火箭由三个子级构成。其中一子级上部装有液体四氧化二氮(N2O4),下部装有液体偏二甲肼(C2H8N2)高能燃料。发动机内燃烧的化学方程式为:C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑,该反应中
A.C2H8N2发生还原反应 B.C2H8N2是氧化剂
C.N2O4发生氧化反应 D.N2O4是氧化剂
难度: 中等查看答案及解析
-
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
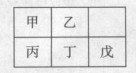
A.原子半径:丙<丁<戊
B.元素金属性:甲>丙
C.氢氧化物碱性:丙<丁<戊
D.丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应
难度: 中等查看答案及解析
-
能在溶液中大量共存的一组离子是
A.NH4+、Ca2+、SO42-、CO32- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、H+、NO3-、MnO4- D.Al3+、Mg2+、SO42-、CO32-
难度: 中等查看答案及解析
-
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是
A.将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性
B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ都正确并且有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 浓硫酸有强氧化性 浓硫酸不能用于干燥H2S和HI气体
B NH4Cl为强酸弱碱盐 用加热法除去NaCl中的NH4Cl
C 溶解度:CaCO3<Ca(HCO3)2 溶解度:Na2CO3<NaHCO3
D SiO2是两性氧化物 SiO2能与NaOH溶液和氢氟酸反应
难度: 中等查看答案及解析
-
下列实验装置(固定装置略去)和操作正确的是

难度: 中等查看答案及解析
-
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.饱和纯碱(Na2CO3)溶液中:c(Na+)=2c(CO32-)
B.pH=4的醋酸中:c(H+)=1.0×10-4mol·L-1
C.0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1
难度: 困难查看答案及解析