-
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,下列说法中正确的是( )
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应难度: 中等查看答案及解析
-
根据气象台天气预报,出现大雾天气将致使高速公路关闭,航班停飞.其中雾属于下列分散系中的( )
A.胶体
B.悬浊液
C.乳浊液
D.溶液难度: 中等查看答案及解析
-
在pH=1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中,可能存在的阴离子是( )
①Cl- ②NO3- ③SO42- ④S2-.
A.①②
B.②③
C.③④
D.①③难度: 中等查看答案及解析
-
2009年世界气候大会在丹麦首都哥本哈根举行,旨在控制大气中二氧化碳、甲烷和其他造成“温室效应”的气体的排放,将温室气体的浓度稳定在使气候系统免遭破坏的水平上.控制二氧化碳排放,更需要从人人做起,“低碳生活”有望成为新的时尚流行全球.“低碳生活”是指生活作息时所耗用能量要减少,从而减低碳特别是二氧化碳的排放.下列不属于“低碳生活”方式的是( )
A.多用电邮、MSN等即时通讯工具,少用传真打印机
B.乘地铁上下班
C.将呼吸产生的二氧化碳用石灰水吸收
D.吃天然食品、穿棉质服装难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是( )
A.2.24L CO2中含有的原子数为0.3NA
B.2.3 g 钠被O2完全氧化时,失去电子数为0.1NA
C.5.6 g 铁粉与硝酸反应失去电子数一定是0.3 NA
D.等体积、等浓度的磷酸和盐酸,电离出氢离子数之比为3:1难度: 中等查看答案及解析
-
已知:
①2BrO3-+Cl2=Br2+2ClO3-;
②5Cl2+I2+6H2O=2HIO3+10HCl;
③ClO3-+5Cl-+6H+=3Cl2↑+3H2O
下列按物质氧化性顺序由强到弱排列正确的是( )
A.Cl2>BrO3->ClO3->IO3-
B.BrO3->ClO3->Cl2>IO3-
C.ClO3->BrO3->IO3->Cl2
D.BrO3->Cl2>ClO3->IO3-难度: 中等查看答案及解析
-
被誉为“光纤之父”的华人科学家高锟荣获2009年诺贝尔化学奖.下列叙述不正确的是( )
A.SiO2是生产光导纤维和粗硅的主要原料
B.SiO2与CO2都属于酸性氧化物,都不能与酸反应
C.SiO2与CO2(干冰)的晶体结构不同
D.水晶的主要成分是SiO2难度: 中等查看答案及解析
-
下列化学用语或模型表示正确的是( )
A.HCl的电子式
B.CO2分子比例模型: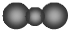
C.NH4I的电子式:
D.Cl-的结构示意图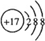
难度: 中等查看答案及解析
-
野外作业时,可用原电池反应放出的热量来加热食品.由铁屑、炭粒、食盐、水、空气组成的原电池中,铁屑作( )
A.正极,发生还原反应
B.负极,发生氧化反应
C.阴极,发生还原反应
D.阳极,发生氧化反应难度: 中等查看答案及解析
-
2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的
Fe原子,有关
Fe的说法正确的是( )
A.它是一种新元素
B.Fe与
Fe互为同素异形体
C.它是一种新原子
D.Fe的中子数是26
难度: 中等查看答案及解析
-
下列实验装置图完全正确的是( )
A.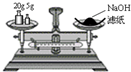
称量氢氧化钠固体
B.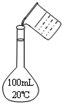
配制100 mL 0.10 mol•L-1盐酸
C.
简易测定中和热
D.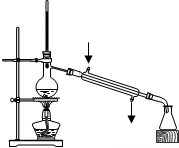
实验室制取蒸馏水难度: 中等查看答案及解析
-
下列物质性质中,可以证明某化合物内一定存在离子键的是( )
A.水溶液能导电
B.由金属和非金属元素的原子组成
C.熔融状态能导电
D.可以溶于水难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.锌和稀硝酸的反应:Zn+2H+═Zn2++H2↑
B.氯气和水的反应:Cl2+H2O═2H++Cl-+ClO-
C.向硫酸铝溶液中滴加过量的氢氧化钡溶液2Al3++3SO42-+3Ba2++8OH-═2AlO2-+3BaSO4↓+4H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3-难度: 中等查看答案及解析
-
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
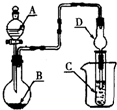
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色难度: 中等查看答案及解析
-
利用相关数据作出的推理或判断不正确的是( )
A.利用键能大小的数据,可以估算化学反应的焓变
B.利用原子半径的数据,可推断元素的主要化合价
C.利用沸点数据,可推测能否将一些液体混合物用分馏的方法分离
D.利用溶度积数据,可比较BaSO4和BaCO3在水中的溶解性大小难度: 中等查看答案及解析
-
镁铝合金5.1g 完全溶于过量的热浓硝酸中,反应中共产生11.2L NO2(标准状况下测定),若在反应后溶液中加入足量的氢氧化钠溶液,则生成沉淀质量为( )
A.13.6 g
B.7.8g
C.5.8g
D.4g难度: 中等查看答案及解析
-
CO与H2在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)⇌CH3OH(g).在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温.实验测得相关数据如下图1和图2.
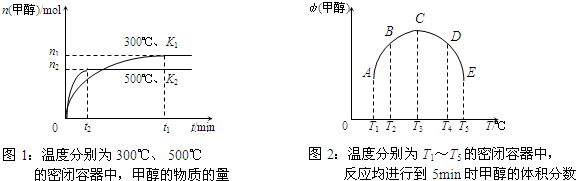
下列有关说法正确的是( )
A.该反应的正反应是气体体积减小的吸热反应
B.K1<K2(K为该条件下反应的平衡常数)
C.反应进行到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
D.将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或减压难度: 中等查看答案及解析
-
下列实验操作或原理不正确的是( )
A.进行焰色反应时,必须用稀硫酸洗涤并灼烧铂丝,然后再进行实验
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
C.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象
D.读取滴定管内液体体积时,俯视读数导致读数偏小难度: 中等查看答案及解析